Ariketak#
Kualitatiboak#
Galderak dira datozen ariketak, horrexegatik izendatu ditut kualitatibo. Bigarren printzipioarekin lotutako kontzeptuak menderatzea eta ondo erabiltzea dute helburu. Askotan, era artifizialean emanda daude, antza, eta halaxe da, hain zuzen ere punturen bat edo beste azpimarratzeko, zehatz izan behar dela adierazteko eta ideiak argi geratzeko. Nabaria izango da asko aldaerak baino ez direla. Honelako galdera teorikoak, normalean, egon daitezke azterketetan, eta aurreko urteetan egindako azterketatxoak dira, gehien bat.
Oso inportantea da ondo irakurtzea eta ariketa oso ona da erantzuna idaztea, eta idatzitako berrirakurtzea eta, askotan, lagungarri gerta daitekeen formularen bat edo beste erabiltzea eta idaztea.
Lehenaren erantzunak jarraian doaz, argi dera dadin nola eman behar diren erantzunak, ariketaren helburuarekin bat etortzeko.
Testuingurua
1. ARIKETA
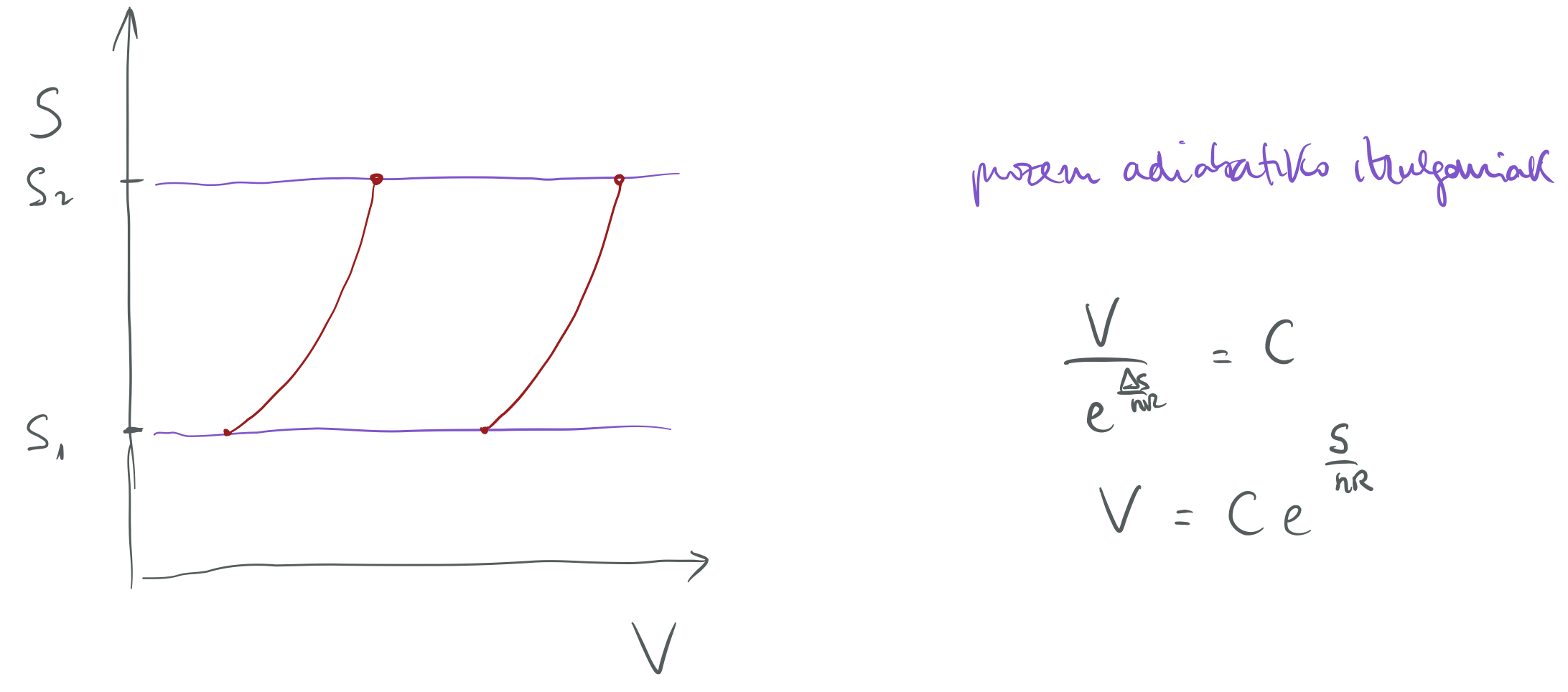
Sistemaren entropia-aldaketa nulua da prozesu adiabatikoetan.
Testuingurua
2. ARIKETA
Aztertu honako baieztapenak, eta azaldu, ongi arrazoituz (dena ondo azalduz), egia ala gezurra diren:
Baldin eta oreka-egoera batean dagoen sistema bati energia kantitate jakin bat ematen bazaio bero eran, sistemak beti lortzen du bukaerako oreka-egoera berbera.
Ezinezkoa da prozesu isotermo batean lana bero bihurtzea amaigabeko eran.
Prozesu isoentropikoak adiabatikoa dakar ondorioz, eta alderantziz.
Testuingurua
3. ARIKETA
Sistemaren entropia-aldaketa nulua da prozesu adiabatikoetan.
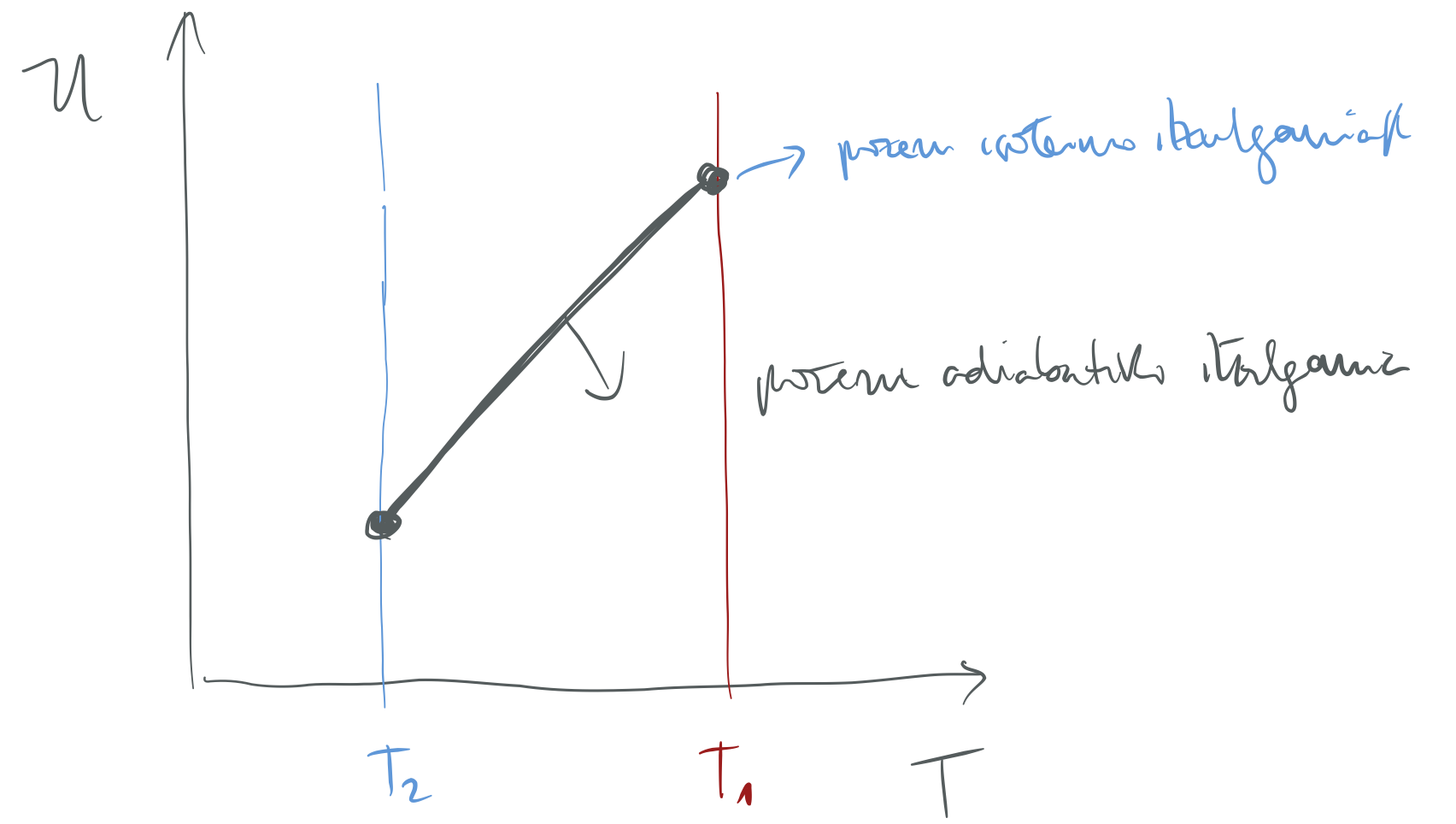
Sistemaren entropia-aldaketa positiboa da prozesu adiabatiko itzulezinetan.
Ingurunearen entropia-aldaketa positiboa da beti, prozesu ez adiabatikoetan.
Lana ezin daiteke oso-osorik bero bihurtu.
Beroa ezin daiteke oso-osorik lan bihurtu.
Prozesu itzulgarri guztietan sistemaren entropia-aldaketa nulua da.
Prozesu adiabatikoari segitu dion sistemaren entropia-aldaketa nulua da.
Esku artean dugun sistemaren espantsio askean, tenperaturak konstante iraun du.
Esku artean duzun sistemak entropia jaso egingo du beroa xurgatuko badu soilik.
Esku artean duzun sistemak zikloa bete du, sistemaren eta ingurunearen entropia-aldaketak nuluak dira beti.
Prozesu isoentropikoak adiabatikoa dakar ondorioz. Alderantzizkoa ere egia da.
Ba al dago jasotzerik edozein sistemaren entropia beste sistemetan inolako aldaketarik sorrarazi gabe?
Itxia den sistemaren kasuan, ez dago barne-loturarik aldatzerik zeinaren ondorioz sistemaren entropia txikiagotuko den.
Aztergai dugun sistema
sistema itxia bada,
sistema itxia bada, barne-loturen konbinazioren bat erabiliz,
sistema itxia ez bada, posiblea da
aurreko aukera guztiak egokiak dira
Esku artean dugun sistema
adiabatiko itzulgarria
isobaro itzulgarria
adiabatiko itzulezina
Arrazoitu zein prozesutan sistemaren entropia-aldaketa txikiena izan den.
Testuingurua
4. ARIKETA
Aintzakotzat hartu ingurunearekin bero kantitaterik trukatu gabe gertatu den prozesua. Ager al daiteke unibertsoaren entropia-aldaketarik? Aipatu bi adibide.
Testuingurua
5. ARIKETA
Horma finko, adiabatiko eta iragazkorreko sistemak prozesu itzulezinari segitu dio, zeinak sistemaren entropia txikiagotu duen.
Testuingurua
6. ARIKETA
Justifikatu ondoko baieztapenak:
Prozesu itzulgarri guztietan sistemaren entropia-aldaketa nulua da.
Prozesu adiabatikoari segitu dion sistemaren entropia-aldaketa nulua da.
Esku artean dugun sistemaren espantsio askean, tenperaturak konstante iraun du.
Motorrak eta hozkailuak#
Testuingurua
7. ARIKETA
Gas ideal baten 1 mol-i bolumena bikoiztu dion espantsio isotermo itzulezina eragin diogu. Bero-iturriaren tenperatura 300 K da, eta 3000 joule da prozesuaren ondorioz egindako lana. Aipatutakoa ba al da Entropia-emendioaren printzipioarekin bateragarria?
Testuingurua
8. ARIKETA
Posiblea al da Carnot-en makina bat motor termiko moduan dabilenean, bero-iturri berotik 100 joule xurgatzea eta bero-iturri hotzari 600 joule ematea; eta, aldi berean, hozkailu moduan dabilenean, bero-iturri hotzetik 600 joule xurgatzea eta bero-iturri beroan 900 joule uztea?
Testuingurua
9. ARIKETA
Esku artean dugun Carnot-en motorrak bete duen zikloan 100 J hartu du goi-tenperaturan dagoen bero-iturritik; eta 20 J utzi, 200 K-ean dagoen bero-iturrian, behe-tenperaturan dagoenean, hain zuzen ere.
Zenbateko presioa erakutsiko du gas-termometroak goi-tenperaturan dagoen bero-iturriarekin ukipenean jarriz gero?
Zenbat lan egin behar da hozkailu moduan aritu dadin?
Testuingurua
10. ARIKETA
Demagun esku artean Carnot-en motorra duzula, zeinean gas ideala dagoen.
Adieraz ezazu grafikoki ziklo bakoitzean gasak beteko duen ibilbidea honako diagrama hauetan:
Lortu etekina kasu bakoitzean.
Testuingurua
11. ARIKETA
Motor bat 127
Entropiaren kalkulua#
Hurrengo ariketetako helburua da entropia-aldaketa kalkulatzea, zenbait sistematan eta zenbait baldintza esperimentaletan. Hori lortzeko, oraindik eskua artean bi tresna baino ez daukazu (formalismoa aldatu arte): entropiaren eragiketa-definizioa (
Prozesua itzulgarria bada, prozesua bera erabil daiteke entropia-aldaketa kalkulatzeko.
Prozesua itzulezina bada, ordea, itzulgarri bat erabiliz ordezkatu behar dugu.
Ordezkatzeak esan nahi du eskua sartu behar dela eta unibertsoa, aldatu: dagoeneko aztertuko duguna prozesua ezberdina izango da enuntziatuarekiko alderatuta. Baina, prozesu itzulgarri ordezkari berezia aukeratuko dugu: enuntziatuko hasierako eta bukaerako oreka-egoera berberak lotzen dituena. Besterik ez dugu behar. Entropia existitzen den funtzioa da; matematikoki diferentzial zehatz baten bidez adierazten da, hots, funtzio matematikoa da. Fisikoki, aldagai termodinamikoen funtzioa izango da. Entropiak sistemaren propietate bat adierazten du: badago esatea hauxe da sistemaren entropia. Hortaz, entropia-aldaketak ez dauka prozesua gertatu den ibilbidearekiko mendekotasunik, hasierako eta bukaerako egoeren mendekoa baino ez da haren balioa.
Zer prozesu ordezkari aukeratuko dugu? edozein, gure esku dago; baina, onena da egokiena aukeratzea.
Zein izango da egokiena? Baldintza esperimentalek gomendatzen dutena. Gomendioa guk geuk ondorioztatuko dugu, jakina. Batetik, hasierako eta bukaerako oreka-egoerak ezagututa eta, bestetik, sistemari buruzko informazioa ezagututa, egoera-ekuazioen bidez, gehienetan. Batzuetan, koefiziente esperimentalak ezagut ditzakegu. Horrelako kasuek lan apurtxo bat gehiago exijituko dute. Gogoratu egoera-ekuazioaren deribatuak direla koefiziente esperimentalak, beraz, egoera-ekuazioa berreskuratzeko, integrazio bat egin behar da: horixe da hain zuzen lan gehigarria. Informazio honen guztiaren bidez aukeratuko dugu prozesu ordezkaria eta hori adierazteko egokien diren aldagai termodinamiko independenteak, horien funtzioan lehenengo printzipioaren adierazpen diferentziala idazteko.
Laburbilduz:
Bereizi prozesua itzulgarria ala itzulezina den.
Itzulgarria denean: prozesua bera erabil daiteke, horretan kalkulatzeko sistemak trukatzen duen beroa
ezaugarritu erabat hasierako eta bukaerako egoerak
sistemari buruzko informazioa erabili:
egoera-ekuazioak edo
koefiziente esperimentalak edo
biak…
aukeratu aldagai termodinamiko independente egokiak
aurreko urratseko informazioa erabiliz
prozesuari buruzko informazioa erabiliz
eraiki
zatitu aurreko adierazpena
integratu hasierako eta bukaerako egoeren artean
Itzulezina denean: prozesua bera ezin da erabili, horretan kalkulatzeko sistemak trukatzen duen beroa
ezaugarritu erabat hasierako eta bukaerako egoerak
sistemari buruzko informazioa erabili:
egoera-ekuazioak edo
koefiziente esperimentalak edo
biak…
aukeratu prozesu itzulgarri ordezkari berezia
prozesua dagoeneko itzulgarri denez, aurreko atalekoa… 2. aukeratu aldagai termodinamiko independente egokiakaurreko urratseko informazioa erabiliz
prozesuari buruzko informazioa erabiliz
eraiki
zatitu aurreko adierazpena
integratu hasierako eta bukaerako egoeren artean
Testuingurua
12. ARIKETA
Aztertu beharreko gas ideala bero-iturriarekin ukipenean dago eta
Lortu gasaren, bero-iturriaren eta unibertsoaren entropia-aldaketak, honako bi kasu hauetan:
espantsioa bat-batekoa bada,
espantsio itzulgarrian.
Testuingurua
13. ARIKETA
Gas ideal monoatomiko baten
Likidoak xurgatu duen beroa.
Gasaren entropia-aldaketa eta barne-energiaren aldaketa.
Gasak egindako lana.
Frogatu
Lortu
Zer motatako transformazio izango da prozesua bi muga-kasuetan?
Testuingurua
14. ARIKETA
Horma adiabatiko higikorrak bi zatitan banatu du esku artean dugun zilindroa. Zilindroko ezkerreko gunea horma diatermoz inguratuta dago eta eskuinekoa, aldiz, horma adiabatikoz. Gune bakoitzean
adierazpen horretan
Lortu:
Eskuineko guneko gasaren entropia-aldaketa eta barne-energiaren aldaketa.
Ezkerreko gasaren entropia-aldaketa, barne-energiaren aldaketa eta xurgatu duen beroa.
Testuingurua
15. ARIKETA
Esku artean dugun sistema irudian ageri dena da: horma guztiak adiabatikoak, higiezinak eta iragaztezinak dituen zilindroa, ezkerrekoa izan ezik, diatermoa bera. Irudian ikus daitekeenez, zilindroaren barnean, higikorra, adiabatikoa eta iragaztezina den pistoia dago. Pistoiak banatu dituen zilindroaren bi guneek van der Waals-en gasaren mol bana dute. Ezkerreko aldean dagoen gasari beroa eman zaio, era kuasiestatikoan, bukaerako tenperatura eta bolumena
Hasierako egoera ondoko hau da:
Eskuineko gunea:
Lortu:
gune bietako gasaren entropia-aldaketa,
ezkerreko aldeko gasaren barne-energiaren aldaketa,
horrek jaso duen bero kantitatea eta egindako lana.
Testuingurua
16. ARIKETA
Esku artean gas ideal baten 1 mol-eko lagina dugu. 25
Lortu unibertsoaren entropia-aldaketa honako bi kasu hauetan:
Lanik egin ez bada.
Egindako lana 2980 joule izan bada.
Testuingurua
17. ARIKETA
Bereizte-horma diatermoak eta higikorrak
Frogatu, bukaerako oreka-egoera lortutakoan, guneei (sistema konposatu moduan) dagokien entropia-aldaketa ondoko hau dela:
Testuingurua
18. ARIKETA
10 eta 15 l-ko gordailuak finkoa, adiabatikoa eta iragaztezina den hormak banandu ditu. Lehenengo gunean SO
Diatermano eta higikor bihurtu dugu bereizte-horma.
Lortu sistema osoari dagokion entropia-aldaketa.Hasierako baldintzetatik abiatuz, bereizte-horma bat-batean kendu dugu.
Lortu sistema osoari dagokion entropia-aldaketa.Gordailuetako gasak berdinak izanik, nola aldatuko lirateke aurreko emaitzak?
Testuingurua
19. ARIKETA
Esku artean dugun hari elastikoa
Lortu honako hauek:
Hariaren entropia-aldaketa, luzatutakoan.
Hariaren entropia-aldaketa, bigarren prozesuaren ondorioz.
Unibertsoaren entropia-aldaketa, bi prozesuen ondorioz.
Luzapenean egindako lana.
Testuingurua
20. ARIKETA
Aztertu beharreko gas erreala era askean zabaldu da,
Lortu honako hauek:
Gasaren entropia-aldaketa, lehenengo prozesuan.
Gasak egindako lana, bigarren prozesuan.
Lan Maximoa#
Testuingurua
21. ARIKETA
Meteorito batek,
Lortu meteoritotik atera daitekeen lan maximoa, eguratsaren tenperatura 30
Testuingurua
22. ARIKETA
A sistema,
Lortu sistematik atera daitekeen
Ondoren,
Testuingurua
23. ARIKETA
Ondokoak dira aztertu beharreko bi sistemen bero-ahalmenak:
Lortu bukaerako tenperatura honako kasuetan:
Ukipena era itzulezinean gertatu da.
Ukipena era itzulgarrian gertatu da eta atera daitekeen lan maximoa.
Testuingurua
24. ARIKETA
Esku artean dugun sistemari esleitu zaion egoera-ekuazioa ondokoa da:
Hauxe da sistemaren hasierako egoera: (600 K, 100 atm).
300 K-ean dagoen bero-iturria erabilgarria da eta sistemaren bukaerako egoera honako hau: (300 K, 1 atm).
Lortu:
Prozesuaren ondoriozko sistemaren entropia-aldaketa eta barne-energiaren aldaketa.
Egoera biak lotzean atera daitekeen lan maximoa.
Sistemaren
Testuingurua
25. ARIKETA
Berdinak diren bi sistemen bero-ahalmenek honako ekuazioari segitu diote:
Sistemen tenperaturak 200 K eta 400 K dira, hurrenez hurren. Ukipen diatermoan ezarriz gero, lortu unibertsoaren entropia-aldaketa eta lan maximoa.
Testuingurua
26. ARIKETA
Esku artean
Besterik gabe, elkarren arteko ukipen termikoan jarri dira.
Zenbatekoa da trukatu duten bero kantitate osoa?Demagun, ondoren,
Zenbatekoa da horrelako egoeratik atera daitekeen lan maximoa?
Jakina, lortu sistemen bukaerako oreka-egoera termikoa, arestian aipatutako bi kasuetan