Ariketak#
Oinarrizko prozesuak, gas ideale(t)an#
Ondorengo ariketetako helburua da Sistema sinplea gaian aztertutakoak lantzea eta horietaz jabetzea. Kontua da, gauzak egiten joateko, benetako sistema bat beharrezkoa dela. Hortaz, ariketak proposatuta daude gas ideala gaia aztertutakoan. Horrela, sistema jakina izango dugu esku artean, masa konstanteko sistema hidrostatiko jakina, bi askatasun-gradukoa baino ez: mekanikoa eta termikoa. Horiek egoera-ekuazio bana dute lotuta
Honako hau da ariketak ebazteko estrategia:
Bildu enuntziatuak sistemari buruz ematen digun informazioa:
egoera-ekuazioak
koefiziente esperimentalak
prozesu bereziekin lotutako informazioa…
Bildu sistemaren egoerekin lotutako informazioa:
hasierakoa, bukaerakoa, tartekoak…
prozesuarekin lotutako informazioa bildu:
baldintza esperimentalak
aldagairen batek konstante dirauen…
Aukeratu deskribapenerako aldagai independenteen sorta
Aldagairen batek konstante badirau, aukeratu aldagai independentetzat. Horrek, prozesuarekin lotutako aldaketa infinitesimalaren adierazpena erraztuko: konstantea den aldagaiaren aldaketa diferentzialak ez du ekarpenik egingo, eta integratu beharreko ekuazioa diferentzialak atal bakarra izango du.
Konbinatu, prozesu jakinaren kasuan, egoera-ekuazioetan dagoen informazioa eta baldintza esperimentalek finkatzen dutena. Hau da:
egoera-ekuazioak deskribatzen ditu sistemarekin lotuta dauden egoera posible denak.
Prozesuak aukeratzen ditu posibleak diren horietatik (egoera-ekuazioak deskribatzen dituen horietatik) baldintza esperimental jakinak betetzen dituenak: idatzi informazio hori.
Sistema: gas ideala
Prozesua:
konstantea
Egoera-ekuazio mekanikoa:
…baina
Orduan, honako hau izango dugu:
Iruzkinak
Gas idealen bero-ahalmenak:
konstanteak dira
Mayer-en erlazio orokortua erabiliz haien kasuan, honako hau da
Gas ideal monoatomikoetan:
Gas ideal diatomikoetan:
Edozein ariketa egiteko, bi motako informazioa erabili behar da:
sistemari buruzkoa:
egoera-ekuazioak, koefiziente esperimentalak…
oreka-egoeraren bat
prozesuari buruzkoa:
kuasiestatiko izan behar du prozesuak
ez bada, barne-energiaren aldaketa baino ezin da kalkulatuaipatutako egoeraren bat horrek egon behar du prozesuan
Ondoko lau ariketetan oinarrizkoak diren lau prozesu aztertuko dira, gas idealaren kasuan: isotermoa (tenperatura konstantekoa), isobaroa (presio konstantekoa), isokoroa (bolumen konstantekoa) eta adiabatikoa (bero-trukerik gabekoa; ikusiko denez, zenbait kasutan, isoentropikoa).
Enuntziatuetako prozesu guztiak kuasiestatikoak dira (era kuasiestatikoan egin dira); eta, beraz, esku artean dugun sistemari dagozkion egoera-ekuazioak erabilgarriak dira. Egoera-ekuazioak sistemaren oreka-egoerak adierazten ditu; eta prozesua era kuasiestatikoan egiten denean, sistema oreka-egoeretatik pasatzen da. Dena dela, ez da nahastu behar: gauza bat da egoera-ekuazioa, eta beste bat prozesuari dagokion adierazpen matematikoa: azken horretan lehenengoa ordezkatu daiteke; alderantzizkoa ezin da egin.
Masa konstanteko gas idealez osatutako laginari dagokion barne-energiaren adierazpena ondoko hau da:
Gas ideala sistema hidrostatikoa da: sistema bakuna. Beraz, bi ezaugarri baino ez ditu: mekanikoa, (
Azkenik Termodinamikaren Lehenengo Printzipioa aplikatuko dugu prozesuetan trukatu den beroa lortzeko:
Testuingurua
1. ARIKETA
Bereizte-horma diatermoz inguraturiko gas ideala dugu esku artean;
egindako lana,
trukaturiko beroa
gasaren barne-energiaren aldaketa.
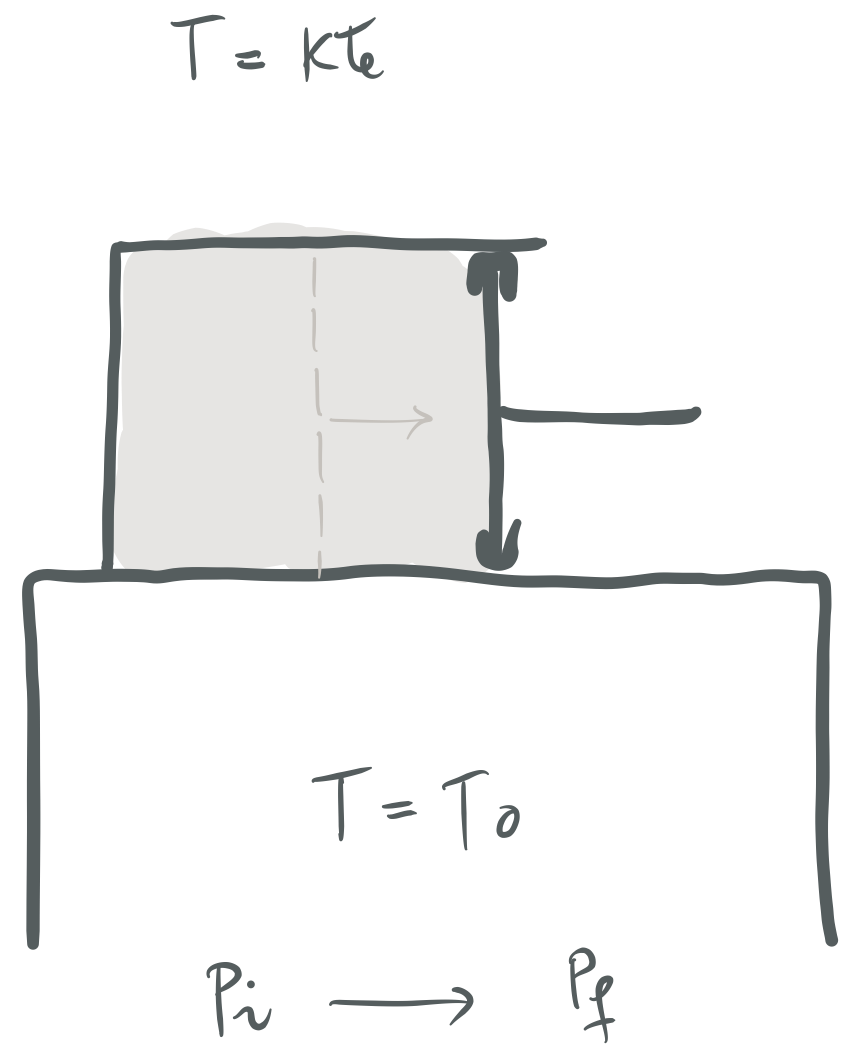
Prozesu isotermoa fisikoki aurrera eramateko eratu daitekeenaren adierazpide grafikoa.#
Testuingurua
2. ARIKETA
Pistoi batek,
Hasierako eta amaierako egoeren presioa eta bolumena,
Kontuan izan honako hauek:
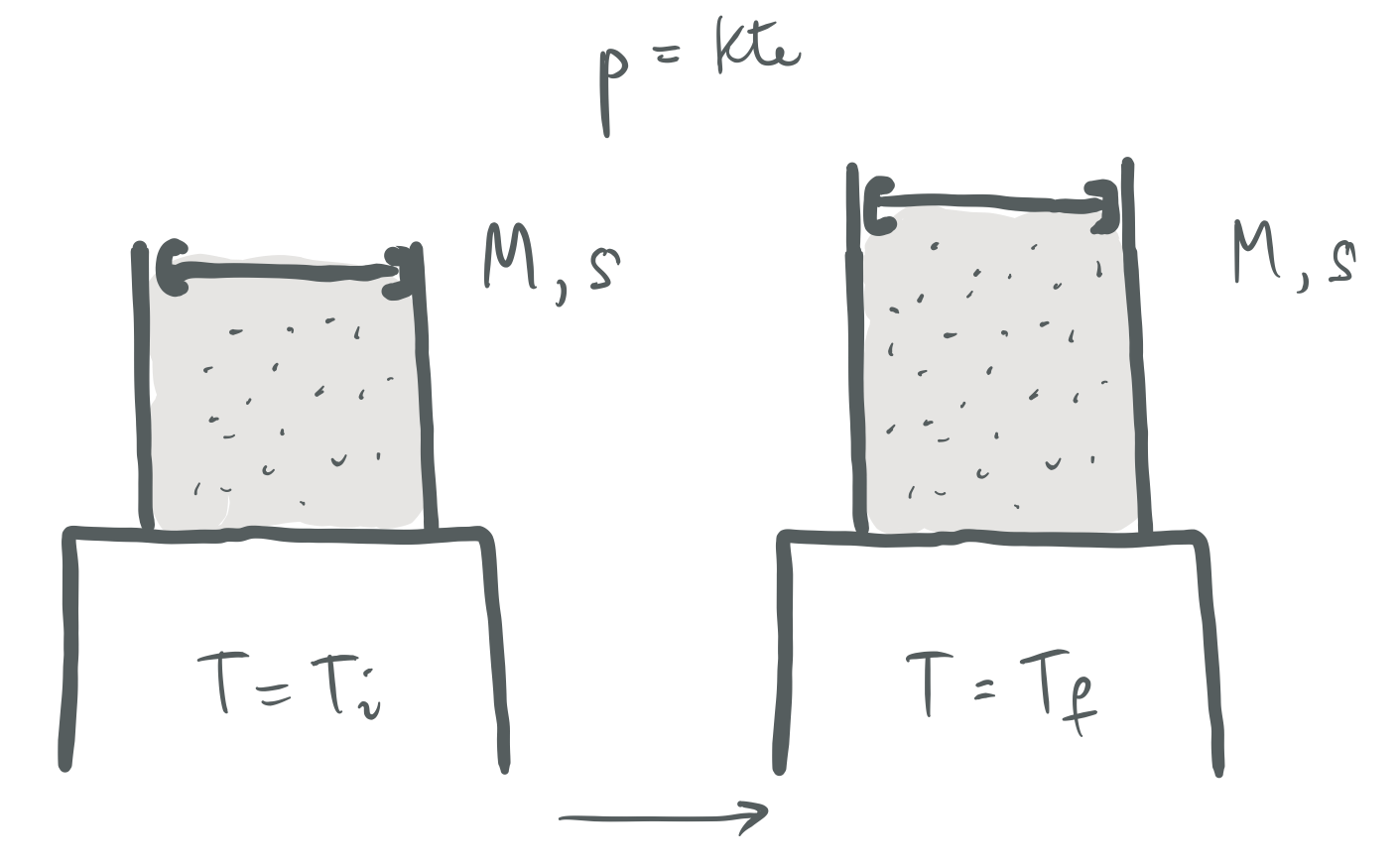
Prozesu isobaroa fisikoki aurrera eramateko eratu daitekeenaren adierazpide grafikoa.#
Testuingurua
3. ARIKETA
Aurreko ariketako sistema berbera dugu; beraz, gas ideala dugu esku artean. Kasu honetan, ordea, bolumena konstante mantenduko dugu. Horretarako, pistoiaren gainean area era jarraituan botako dugu. Lortu:
Botatako are kantitatea,
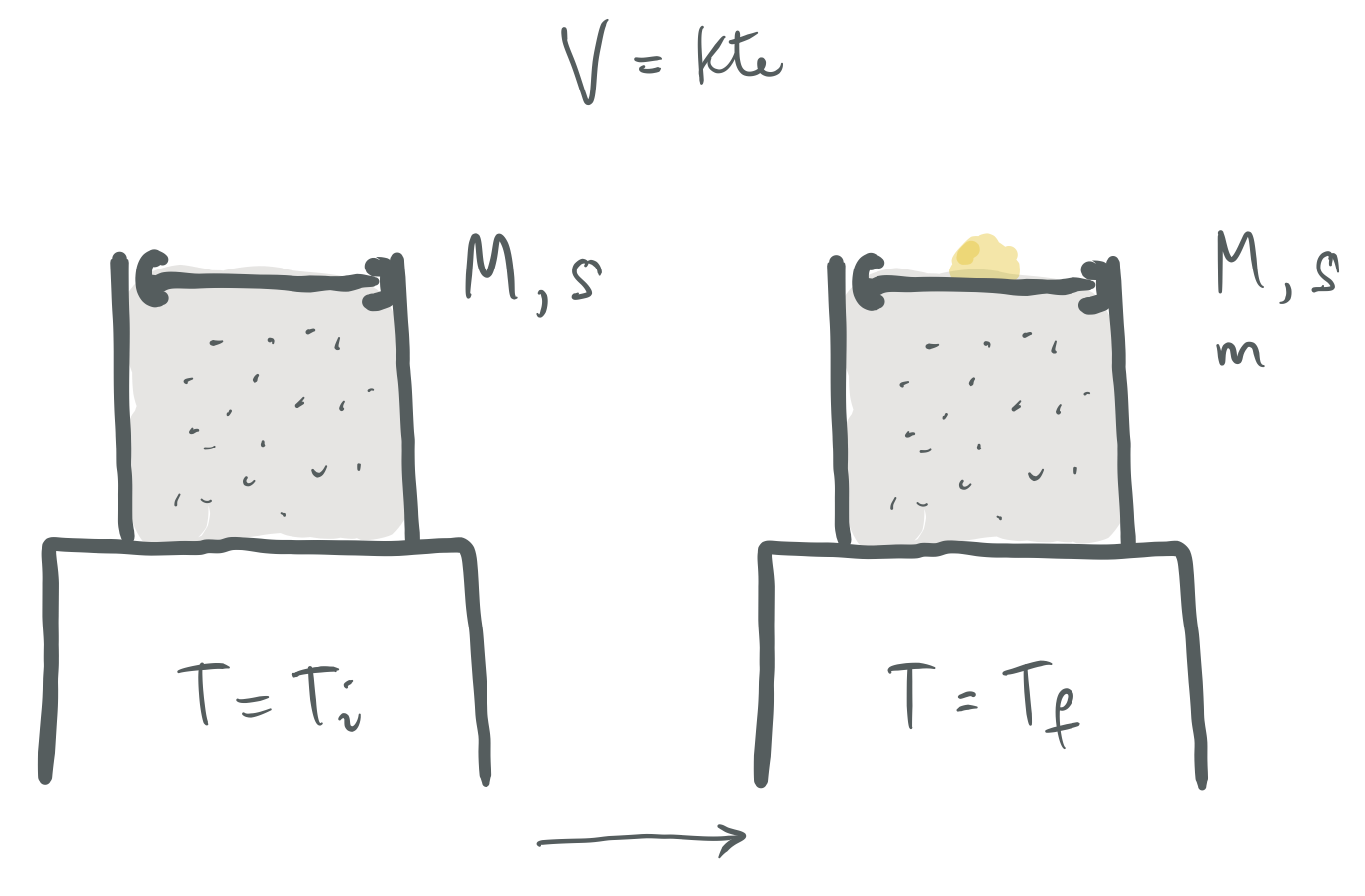
Prozesu isokoroa fisikoki aurrera eramateko eratu daitekeenaren adierazpide grafikoa.#
Testuingurua
4. ARIKETA
Aurreko ariketako zilindroaren hormak adiabatikoak direla onartuko dugu, oraingo honetan, eta hasierako tenperatura,
Zenbateko masa kantitate gehitu behar diogu pistoiari kuasiestatikoki, bukaerako tenperatura
Lortu
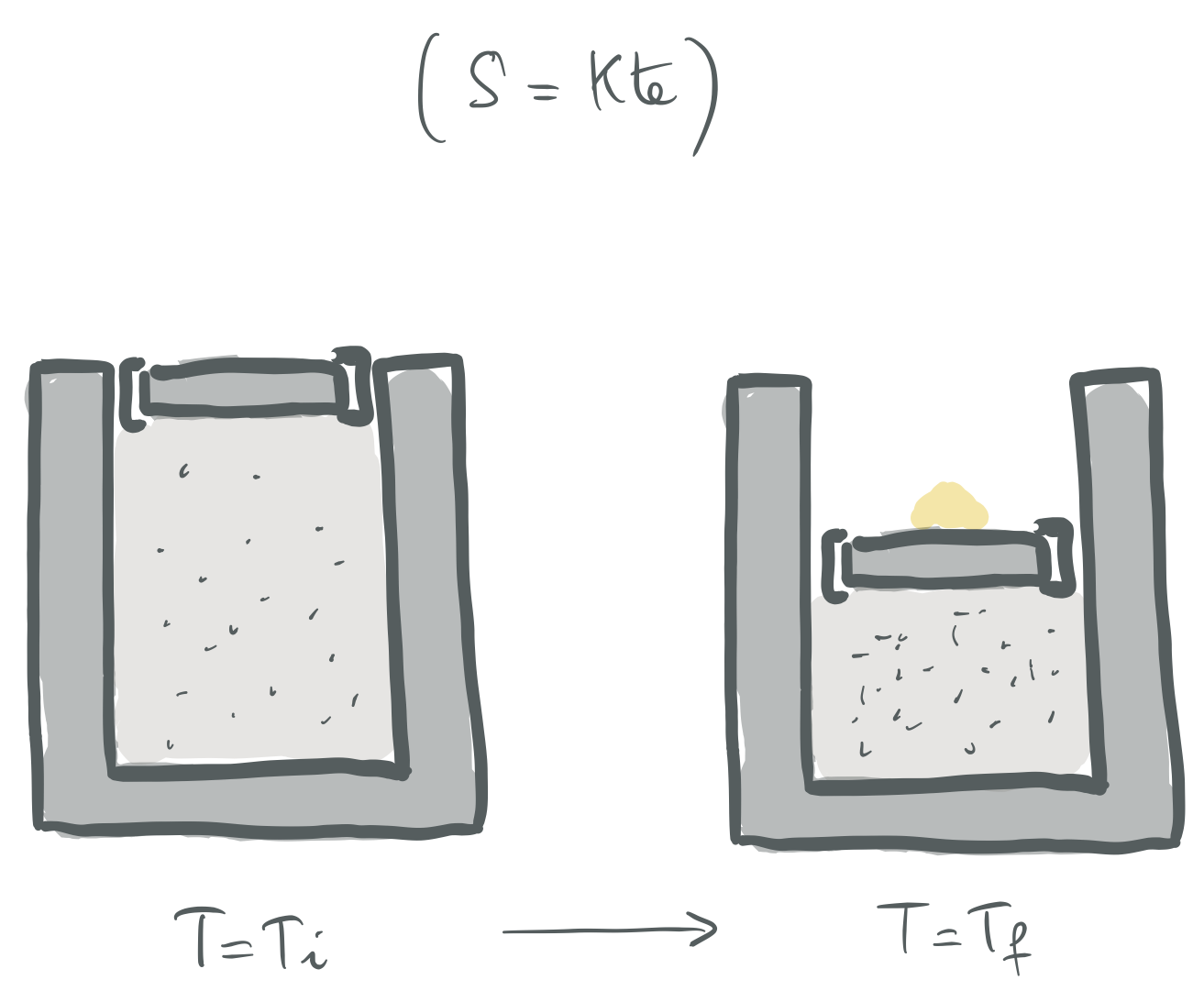
Prozesu adiabatikoa, ikusiko denez, isoentropikoa bera, fisikoki aurrera eramateko eratu daitekeenaren adierazpide grafikoa.#
Iruzkinak
Aurreko horiek guztiak lortzeko badago beste modurik. Lehen printzipioaren adierazpen diferentziala izan daiteke abiapuntua. Jakina, horretarako, ondorioztatutako adierazpenetatik egokia aukeratu behar da; hots, aztergai den prozesuarekiko aldagai termodinamiko independente egokituak erabiltzen dituena.
Esaterako, prozesu isotermoaren kasuan, prozesua bera deskribatuta dago
Honako hau da erabili beharreko lehen printzipioaren adierazpen diferentziala:
Sistemari buruzko informazioa erabilita:
Baina
Puntu horretan, egoera-ekuazioa (mekanikoa) erabil daiteke berriro eta arestian lortutako emaitza berreskuratu:
Beste prozesuei dagokienez honako hauek dira lehen printzipioaren adierazpen egokiak, aldagai termodinamikoei dagokienez:
Isobaroa
Jakina, horixe da modua presio konstantea denean, horrek definitzen du ibilbidea diferentzial ez-zehatza kalkulatzeko, sistemak trukatu duen bero kalkulatzeko. Bestetik, kasu berezi
Isokoroa
Jakina, horixe da modua bolumena konstantea denean, horrek definitzen du ibilbidea diferentzial ez-zehatza kalkulatzeko, sistemak trukatu duen bero kalkulatzeko. Sistemak ez du lan mekanikorik egin, bolumena ez baitu aldatu. Beraz, barne-energiaren aldaketa da trukatu duen beroa. Dena dela, kasu berezi honetan argi zegoen, gas idealean
Adiabatikoa:
Prozesu berezi-berezia#
Testuingurua
5. ARIKETA
Berogailu elektrikoaren bidez 500 m
Gas idealak, aplikazioak#
Testuingurua
6. ARIKETA
Zein da prozesu politropiko baten malda
Testuingurua
7. ARIKETA
Airearen jokaera gas idealarena dela onartuz eta Hidrostatikaren Ekuaziotik abiatuz (
Testuingurua
8. ARIKETA
Fisikari mendizale batek honako altimetroa hau asmatu du:
Testuingurua
9. ARIKETA
Har itzazu aintzakotzat zilindro baten barnean dauden gas ideal baten
Indize politropikoa,
Testuingurua
10. ARIKETA
Jarraitu al diezaioke gas ideal monoatomikoak irudian adierazi den prozesuari?
Eta gas ideal diatomikoak?
Baiezkoan, zein gasetan gertatuko da tenperatura-aldaketarik handiena?
Zer gertatzen da
Onartu bi gas idealen mol kopuruak berdinak direla.
Proposatutako prozesua,
Testuingurua
11. ARIKETA
Monoatomikoa eta diatomikoa diren bi gas (ideal) desberdinak tenperaturaren eta bolumenaren balio berberen bidez ezaugarritu ditugu.
Haien bolumenak hasierako balioaren erdira izan arte konprimitu ditugu adiabatikoki.
Zein dago tenperatura handiagoan?
Zikloak#
Ondoren datozen ariketetan, sistema, edo sistemak, gas ideala(k) izango d(ir)a, aurrekoetan bezalaxe. Oraingo hauetan, aldiz, ariketen helburua zikloak aztertzea eta horietan trebatzea da.
Arestian aipatu den moduan, gas idealak direnez, gas idealarekin lotutako taula beti erabil daiteke, kontrakorik esan ezean.
datuak |
|||
|---|---|---|---|
e-e mekanikoa |
|||
e-e termikoa |
|||
bero-ahalmenak |
Mayer-en erlazioa |
||
monoatomikoa |
|||
diatomikoa |
|||
indize adibatikoa: |
monoatomiko: |
diatomiko: |
|
koefiziente esperimentalak |
Oso gomendagarria da, kasu hauetan ere bai, irudiak, eskemak, grafikoak egitea. Gehienetan, ikusiko duzunez,
Testuingurua
12. ARIKETA
Esku artean ditugun gas idealaren 4 mol termikoki isolatuta dagoen zilindroan daude, 6 atm-n eta
Lortu ondokoak:
amaierako tenperatura,
barne-energiaren aldaketa,
trukatutako beroa, eta egindako lana.
Testuingurua
13. ARIKETA
Gas ideal bati, 300 K-eko tenperaturan dagoena eta 1 mol-ekoa bera, bolumena bikoiztu dion beroketa isobarikoa eragin diogu. Ondoren, hozketa isokoroaren bidez presioaren balioa hasierako presioaren erdira jaitsi dugu. Azkenik, hasierako egoerara eraman duen konpresio isotermoa eragin dugu. Prozesu guztiak itzulgarriak dira.
Lortu
Testuingurua
14. ARIKETA
Esku artean duzun nitrogeno kantitatearen egoerari dagozkion ezaugarriak honako hauek dira:
Beste egoera batean aldiz, sistema ezaugarrituko duten aldagai termodinamikoen balioak, hauexek dira:
Lortu:
Gasak jasotako bero kantitatea, egoera batetik bestera joandakoan.
Zabaldutakoan, gasak egindako lana.
Gasaren barne-energiaren aldaketa.
Testuingurua
15. ARIKETA
Ebatz ezazu ariketa berbera, honako kasu hauetan:
Hasierako egoeratik amaierako egoerarako ibilbidea ABD denean.
Hasierako egoeratik amaierako egoerarako ibilbidea ACD denean.
Ibilbideak alboko irudian adierazi dira.
Testuingurua
16. ARIKETA
Gas ideal baten 1 mol,
2
2
Hasierako egoerara eramango duen prozesu isobaroa.
Irudikatu zikloa,
Lortu zikloarekin etekina eta alderatu aipatu zikloko muga-tenperaturen artean arituko litzatekeen Carnoten zikloari dagokionarekin.
Testuingurua
17. ARIKETA
Makina termiko batek aldameneko irudiko zikloa bete du.
Makinaren
Hartu kontuan
Testuingurua
18. ARIKETA
Gas ideal baten 1 mol
Lortu
Zein motatako prozesua da hirugarrena?
Testuingurua
19. ARIKETA
Gas ideala ondoko zikloa betetzera behartu dugu:
konpresio isokoro itzulgarria, (
espantsio adiabatiko itzulgarria, (
konpresio isobaro itzulgarria, (
Irudika ezazu zikloa
Demagun 1 mol dugula, eta
Lortu gasak emandako eta xurgatutako bero kantitateak, eta zikloaren etekina.
Eman ezazu emaitza
Testuingurua
20. ARIKETA
Gas ideal baten 1 mol-ek bi lerro isotermoz eta bi lerro isokoroz osatutako zikloa bete du. Gasaren bolumena
Aldera itzazu sistemak kanporatu duen lana eta zikloan ageri diren muga-tenperaturen artean arituko litzatekeen Carnot-en zikloari dagokiona.
Espantsio isotermoan sistemaren bolumena bikoiztu da.