Apunteak#
06 Gaia: Termodinamikaren bigarren printzipioa#
Historias del metabolismo. ¿Por qué somos simios caros?
Juan Ignacio Pérez Iglesias explica cómo el metabolismo humano requiere mucha energía para mantener en funcionamiento el cerebro y otros procesos biológicos.
Publicado: 17/10/2022 15:58 (UTC+2) Última actualización: 17/10/2022 15:58 (UTC+2)
6. Gaia:, 6Z, 7Z, 8Z

Iruzkinak:
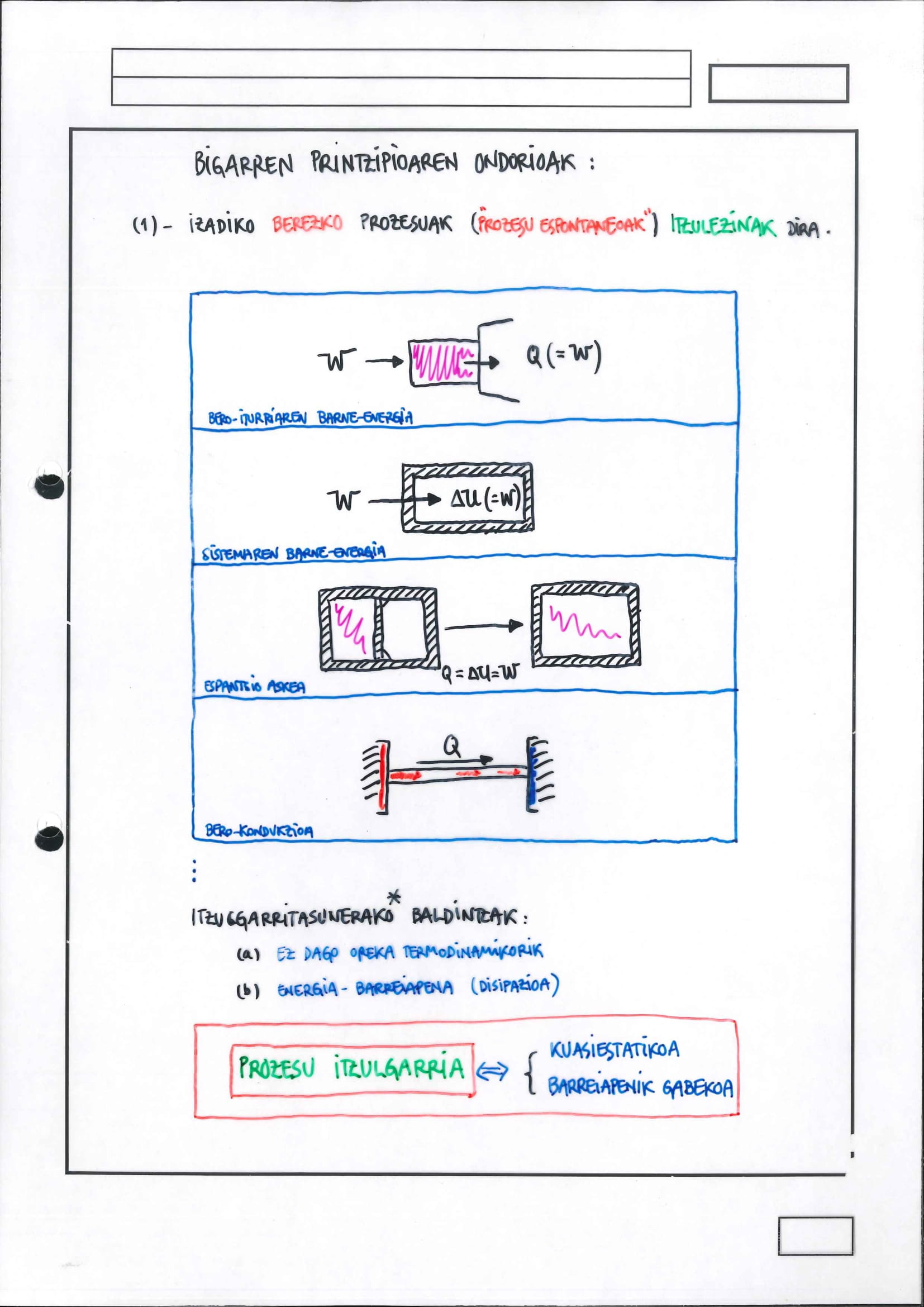
Bigarren Printzipioak esaten du posibleak diren prozesuen artean, hots, Lehen Printzipioarekin bat egiten dutenen artean, zein gertatzen diren berez Lehen Printzipioaren arabera edozein prozesu gerta daiteke aurrera zein atzekoz aurrera, noranzko batean energia kontserbatzen bada, kontrakoan, baita ere Horixe da beheko irudian adierazi dena
Lehen eta bigarren Printzipioen eduki fisikoa.#
ordenatuetan dago unibertsoari (erabat isolatutako sistemari, beraz,) dagokion energia eta, abzisetan egoerak daude, egoera orokorrak, edozein egoera.
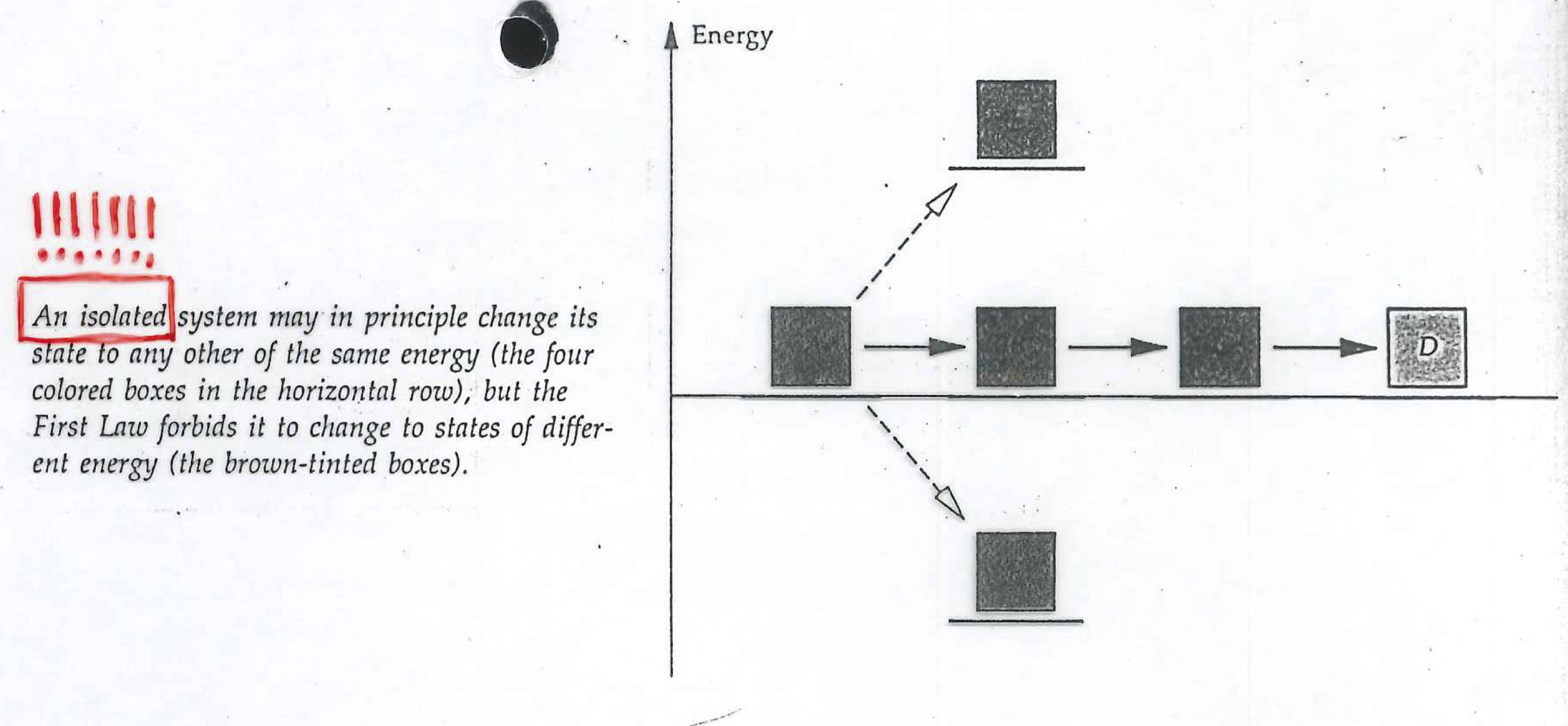
Lehen Printzipioaren arabera, energia kontserbatzen da (ez da ezer egin behar horretarako, Izadia arduratzen da horretaz) eta, beraz, ordenatu bereko egoerak baino ezin ditu lotu edozein prozesuk.
Hala ere, posiblea da
posiblea da ordenatu berean ez dauden egoerak lotzen dituzten prozesuak eragitea, baina kasu horietan, eskua sartu beharko da; eskua sartuta, unibertsoa aldatzen da: eskua sartzean ingurunearekin lotzen baita, edozein modutan (edozein askatasun-graduren bidez) ordura arte benetako unibertsoa zena
Bigarren Printzipioak argitzen du ordenatu berean dauden egoeren arteko zer prozesu gertatzen den berez:
Esan bezala, berez gertatzen den prozesua ez dago debekatuta, baina zerga dauka berarekin lotuta: aurrera eraman ahal izateko, eskua sartu egin behar da eta hori, Izadian, energia gastatzea da. Ez dago dena galduta baina!
berezko prozesua erabil daiteke berezkoa ez den prozesua eragiteko, horretarako, aipatutako bi prozesuak akoplatu behar dira. Jakina, prozesu efektiboak bat egin behar du Bigarren Printzipioarekin, oraingo honetan, Entropia-emendioaren forman emanik, esaterako.
Entropia-emendioaren arabera, guztiz isolatutako (unibertsoaren) entropia-aldaketaren zeinua finkatuta dago:
Baina
6.1 Izadiko asimetria

Ez da ezer frogatuko, aldiz, argumentuak erabiliko dira onargarritasuna onartzeko; hots, dena da ideal
Izadian asimetria dago: prozesu batzuk berez (naturalki, era naturalean, …) gertatzen dira noranzko batean, baina ez kontrakoan baina ez dira gertatzen era naturalean, berez, kontrako noranzkoan…
asimetria horren adierazgarri:
lana
Kontuanizan zer eredu erabiltzen den transformazio mota hori aztertzeko: sistemaren egoera ez da aldatzen. Oso garrantzitsua da ereduaren ezaugarriak ondo ezagutzea, bestela, ez dabil.denon esperientzia dira honako hauek:
inork ez du inoiz ikusi beroa tenperaturaren maldan gora
inork ez du inoiz ikusi mahai batean, esaterako, pausagunean dagoen pilotak berez, besterik gabe, gora egiten
horiek guztiak, eta gehiago, dira asimetriaren aurpegiak
6.2 Zikloak eta makina termikoak
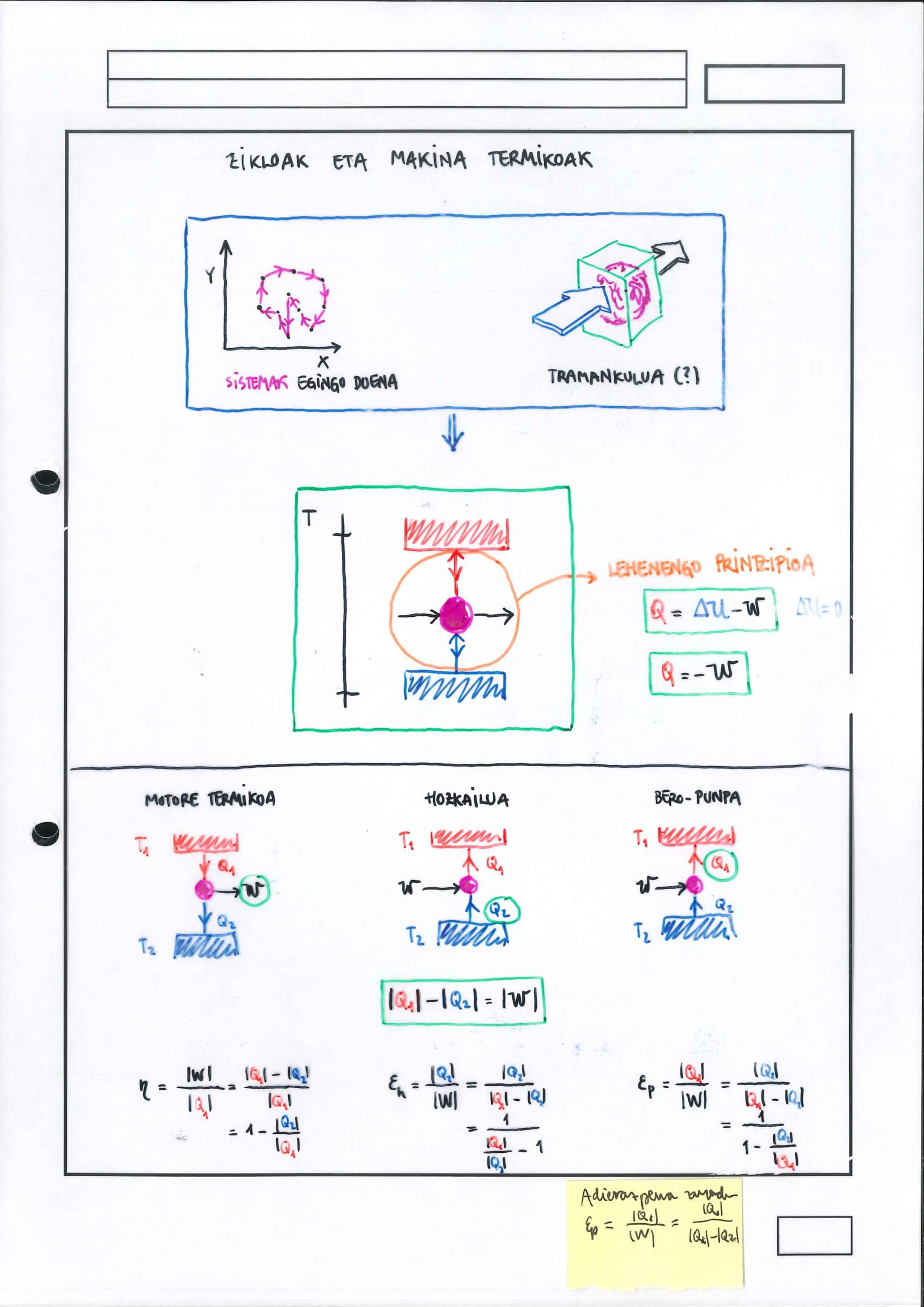
eskua sartuz, berezkoak ez diren prozesuak abiarazteko zikloak eta makinak (termikoak) beharrezkoak dira
makina termikoetan beti erabiltzen da eskema grafiko berbera horretan, bi bero-iturri baino ez dira adierazten, baina, kontuz!, horrek ez du esan nahi bi bero-iturrik baino ez duela beti parte hartzen edozein ziklotan:
goi-tenperaturan dagoen bero-iturri bakarrak adierazten du efektiboa izan den (ziklikoki dabilen) sistemaren bero-xurgapena, nahiz eta xurgapen-azpiprozesu asko (bat baino gehiago) egon daitezkeen zikloan
behe-tenperaturan dagoen bero-iturri bakarrak adierazten du efektiboa izan den (ziklikoki dabilen) sistemaren bero-kanporatzea, nahiz eta kanporatze-azpiprozesu asko (bat baino gehiago) egon daitezkeen zikloan
jakina, sistema bera da erreferentzia (erreferentzia-sistema) bero-trukeei dagokienez
lehen printzipioa aplikatzen zaio ziklikoki dabilen sistemari:
ziklikoki dabilenez:
hiru makina termiko aztertuko da eta beti erabiliko da eskema grafiko berbera, nahiz eta interpretazio bana duten makinek, helburu banakoak baitira makinak:
motor termikoa:
helburua da tenperatura-diferentzia aprobetxatzea lana egiteko
berarekin lotutako parametroa
hozkailua:
helburua da tenperatura-diferentzia sorraraztea, horretarako, lana egin behar da
berarekin lotutako parametroa
bero-ponpa:
helburua da goi-tenperaturan dagoen sistema bati energia (bero moduan) ematea, horretarako lan egin behar da
berarekin lotutako parametroa
makina horiek guztiak ezaugarritzeko erabiltzen diren errendimenduak positiboak dira horrexegatik beti erabili behar dira balio absolutuak
errendimenduen adierazpenetan agertzen diren
edo
6.3 Termodinamikaren Bigarren Printzipioaren (bi) enuntziatu

2.garren Printzipioaren zenbait enuntziatu dago; oraingo honetan klasikoenak aztertuko dira.
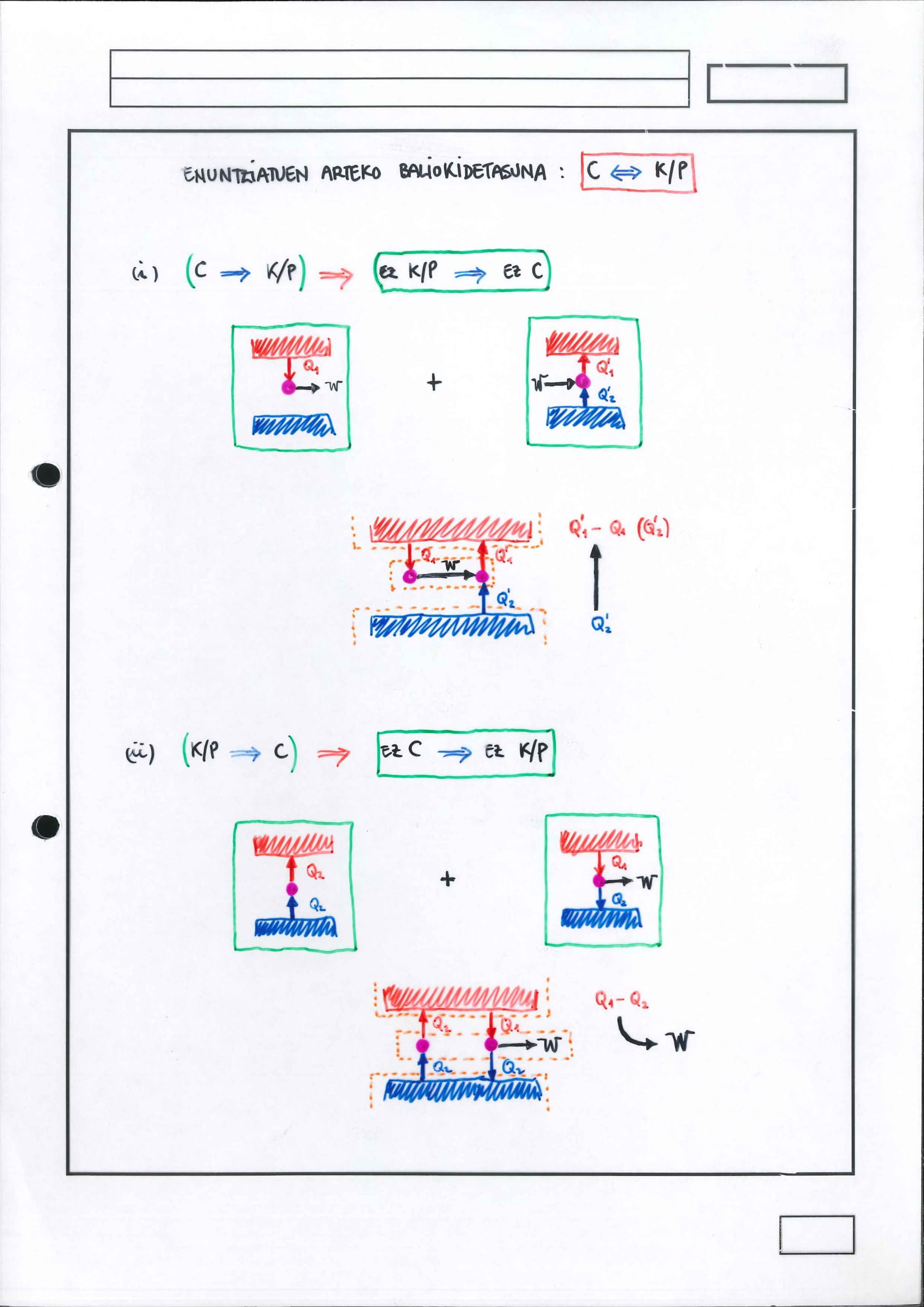
Ematen du ez dutela inolako loturarik, baina asimetria berberaren bi aurpegi baino ez dira.
Kontuz! Izugarri garrantzitsua da inolako eraginik gabe, eskua sartu gabe, besterik gabe… modukoak beti esatea enuntziatuak aipatzen direnean. Horrelakorik aipatu ezean, ez zaio Izadiko asimetriari erreferentzia egiten:
posiblea da hotz dagoen sistematik beroago dagoen beste sistema batera energia pasatzea (pasaraztea), prozesuaren noranzko hori ez dago debekatuta, baina, horretarako eskua sartu egin behar da: lana egin behar da.
posiblea da oso-osorik beroa lan bihurtzea, baina bero hori da bi bero efektiboren arteko batura aljebraikoa; hots, badago eraginik, bero eran pasatzen zaio energia inguruneari eta, bide batez, lana egiten da
Atkins-i segituz: 2. Printzipioarekin lotutako aldagai termodinamikoa
6.4 Termodinamikaren Bigarren Printzipioaren bi enuntziatuen baliokidetasuna
6.5 Itzulgarritasuna/itzulezintasuna kontzeptua
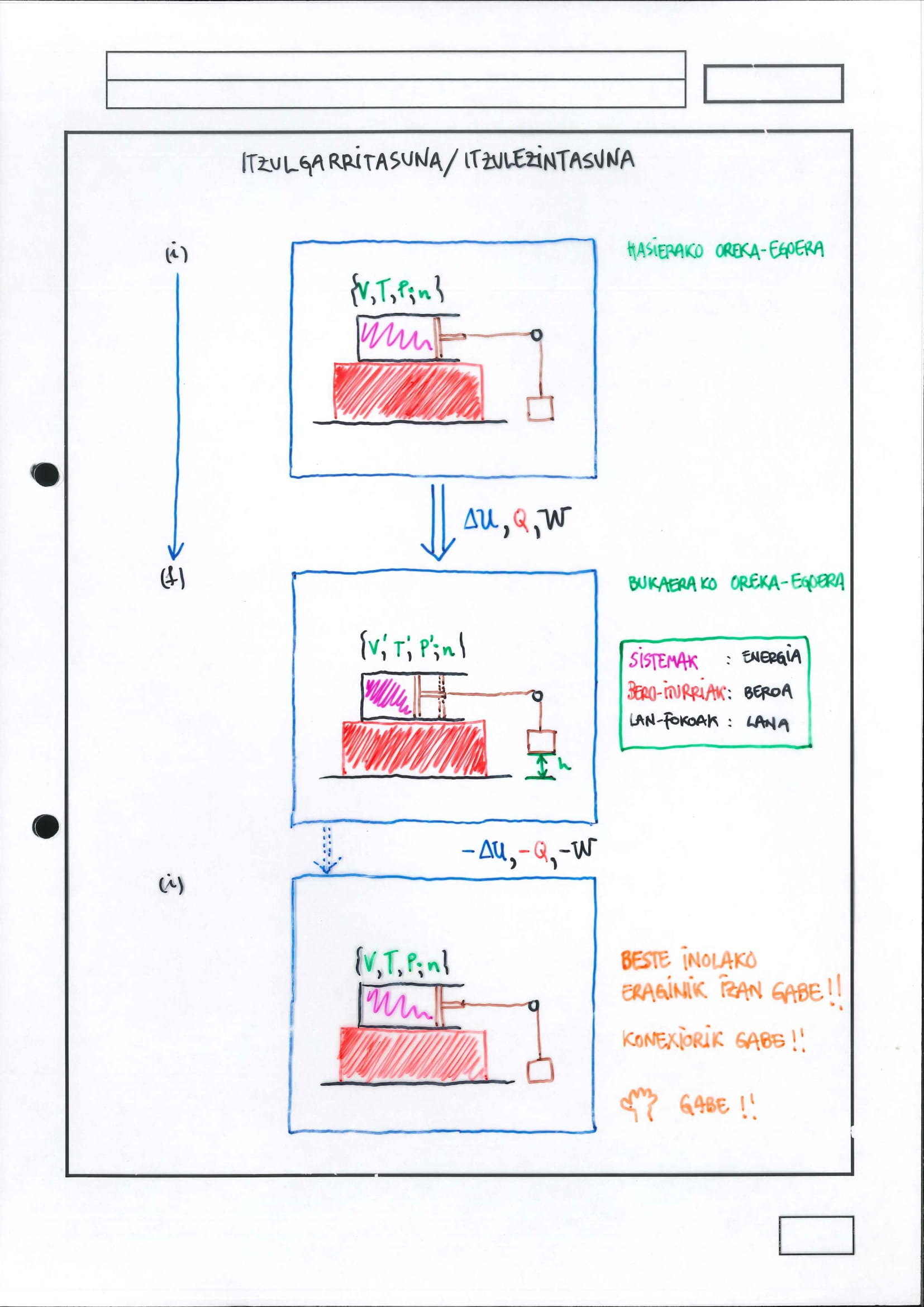
6.6 Bigarren Printzipioaren Ondorioak:
Berezko prozesuen sailkapenak eta aztertzeak hiru ondorio dauka:
berez gertatzen diren prozesuei buelta emateko, kontrako noranzkoan eragiteko, Bigarren Printzipioaren aurka egin behar da; beraz, ezinezkoak dira kontrako noranzkokoak eta, ondorioz, berez gertatzen diren prozesuak itzulezinak dira
hortaz, horrexegatik, propietate komuna dute berezko prozesuek: energia-barreiatzea, edozein motatakoa, haiekin lotuta dago: barreiatutako energia hori, bero moduan, da lan bihurtu beharko litzakeena buelta emateko prozesuari…ezinezkoa bera
aipatutako propietate komun horren bidez, ondorioztatzen dira itzulgarritasunerako baldintzak: prozesuak izan behar du, aldi berean,
kuasiestatiko
energia-barreiaketarik gabeko
metodo axiomatikoa:
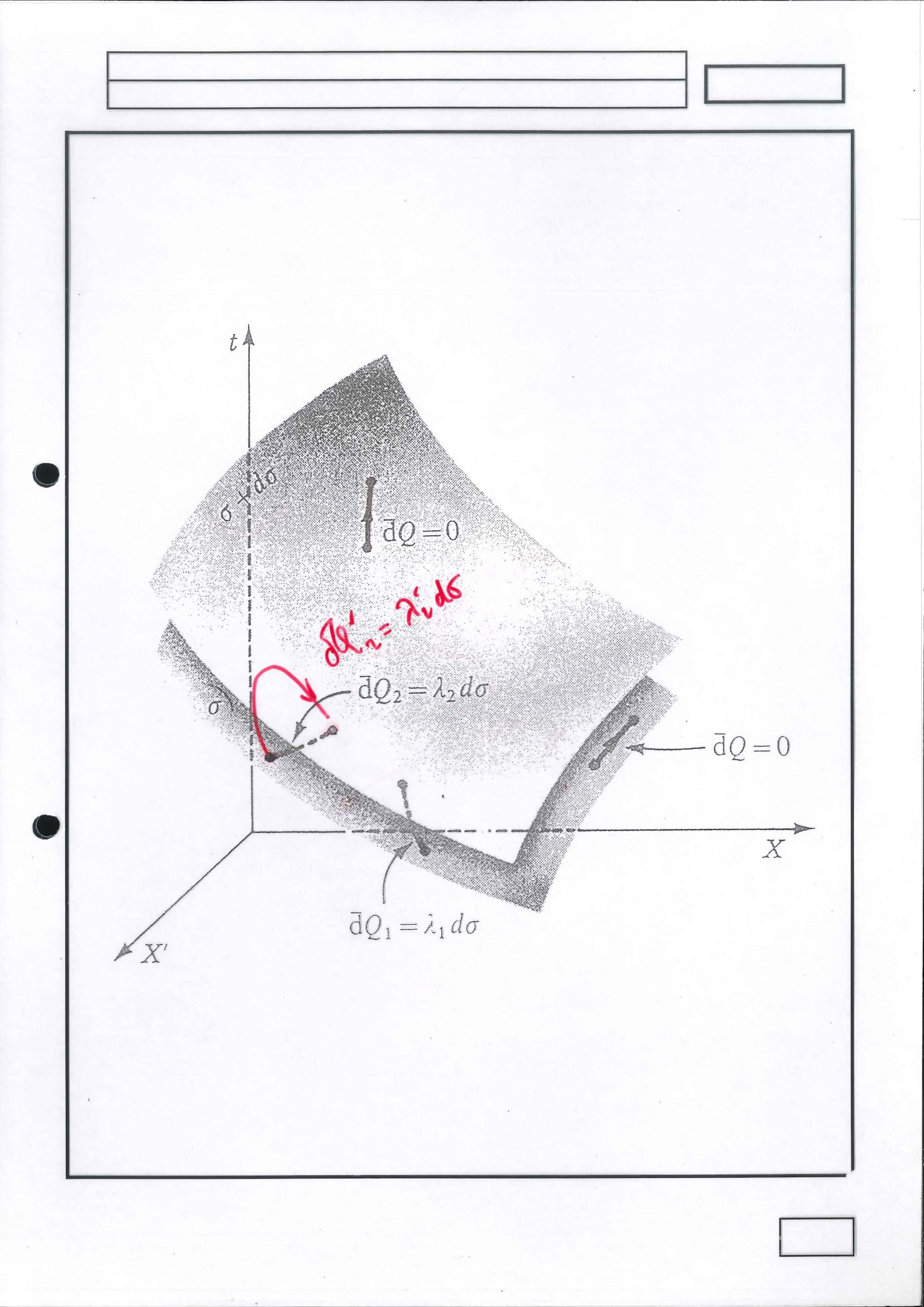
Gainazal Adiabatikoen Existentzia:
aldagai bakarreko sistema
kasu honetan lehen printzipioa baino ez da behar, ez da bigarren printzipioaren potentzia osoa behar
dena dela, kontuan hartu behar da behin baino gehiagotan aipatutakoa: aztertzen den prozesua ez da soilik kuasiestatiko; aldi berean itzulgarria da
esan bezala, hori ez da azpimarratzen liburuan, nahiz eta bai komentatzen den
gogoratu gas idealaren kasuan lortu direla prozesu adiabatiko kuasiestatikoei dagokien forma (edozein diagramatan): prozedura berbera da
aldagai anitzeko sistema
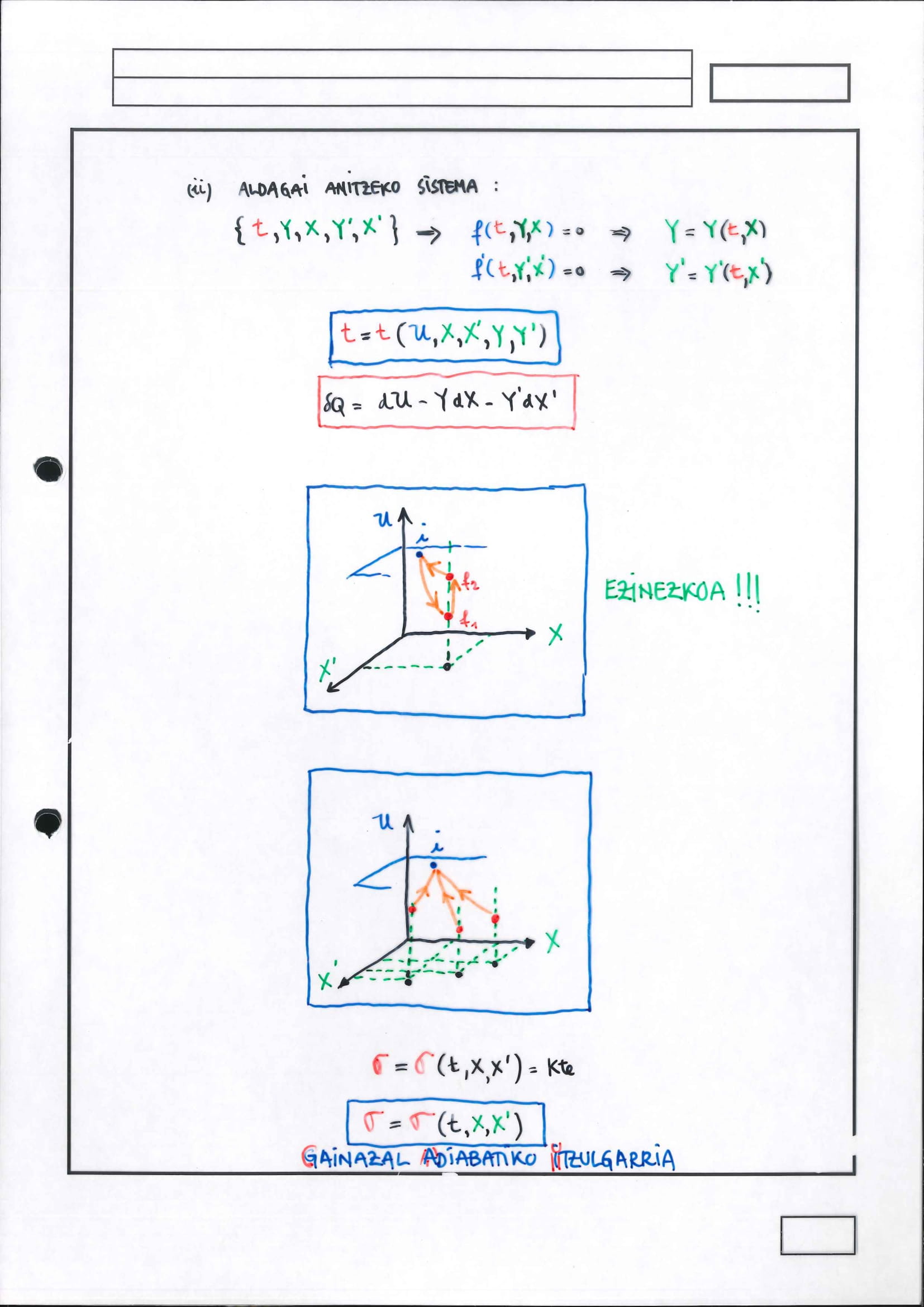
Aldagai anitzeko edozein sistemaren kasuan derrigorrean erabili behar da 2. printzipioaren indar osoa
frogapena egin da konfigurazio-espazio berezi batean: hiru dimentsiokoa (fisikoki sistemak hiru askatasun-gradu baino ez dauka) baino ez bera, nahiz eta ondorioa erabat orokorra den eta, gainera, askatasun-graduak deskribatzeko erabili diren aldagaiak dira
nahikoa da diagrama bakarrean lortzea frogapena
ondorio da:
existitzen den funtzioa denez:
diferentzial zehatza da
sistemaren propietate bat adierazteko erabil daiteke, beste edozein aldagai termodinamikoren antzera
aldagai independenteen sortakoa izan daiteke eta, beraz, esaterako, honako hau idatz daiteke:
Gainazal adiabatiko itzulgarriek ezin dute elkar ebaki: hala balitz, frogapenean erabilitako argumentu berberak erabiliz berriro 2. Printzipioaren aurka egingo luke ziklo hipotetikoak eta kontraesana ondorioztatu beharko litzateke

Edozein sistemaren kasuan eta edozein prozesu itzulgarritan, kuasiestatiko eta energia-barreiaketarik gabeko bera, sistemak trukatzen duen beroa beti da honako hau:
beroak ez du galtzen bere ez-zehatz izaera: beroa beti da diferentzial ez -zehatza, baina, era itzulgarrian trukatutako beroak beti dauka faktore integratzailea
frogapenetik ondorioztatzen da, derrigorrean honako hauek identikoki nuluak direla:
hots, beti betetzen dira: definiziotzat har daitezke, horien moduko orokor bat baino ez da idatziko, errazteko:
Faktore integratzailearen esangura fisikoa

honako hau
egiatan, faktore integratzailea
faktore integratzailean ez da (edozein) sistemari buruzko informazioa agertzen
faktore integratzailean soilik agertzen da
faktore integratzailea unibertsala da: sistemak era itzulgarrian bero-trukea egin duen egoera termikoaren menpekoa baino ez da; beroa trukatzen den egoera termikoen menpekoa
frogapena

oso interesantea da frogapena, trebatzeko (ariketa-proposamena)
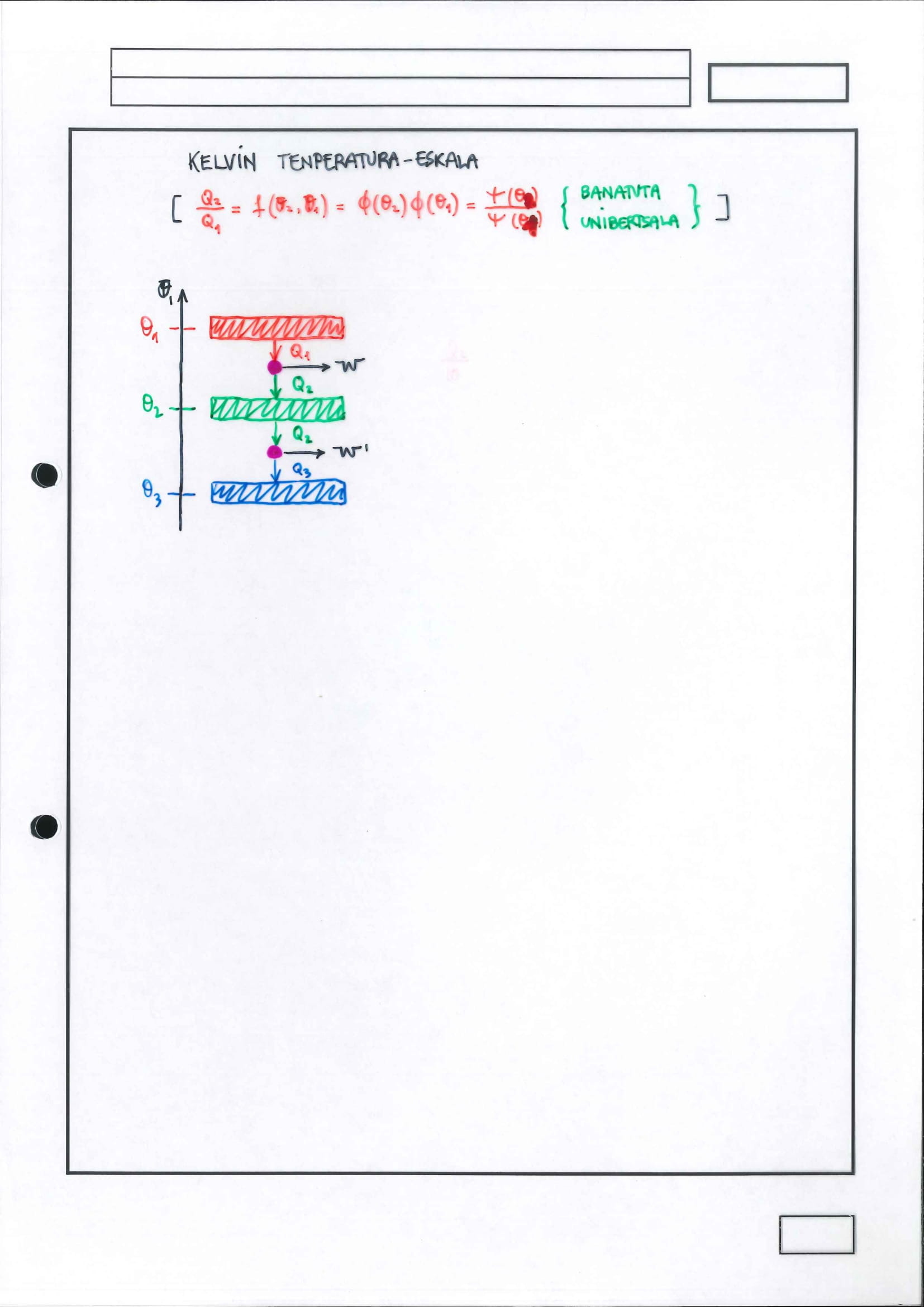
Kelvin tenperatura-eskala*
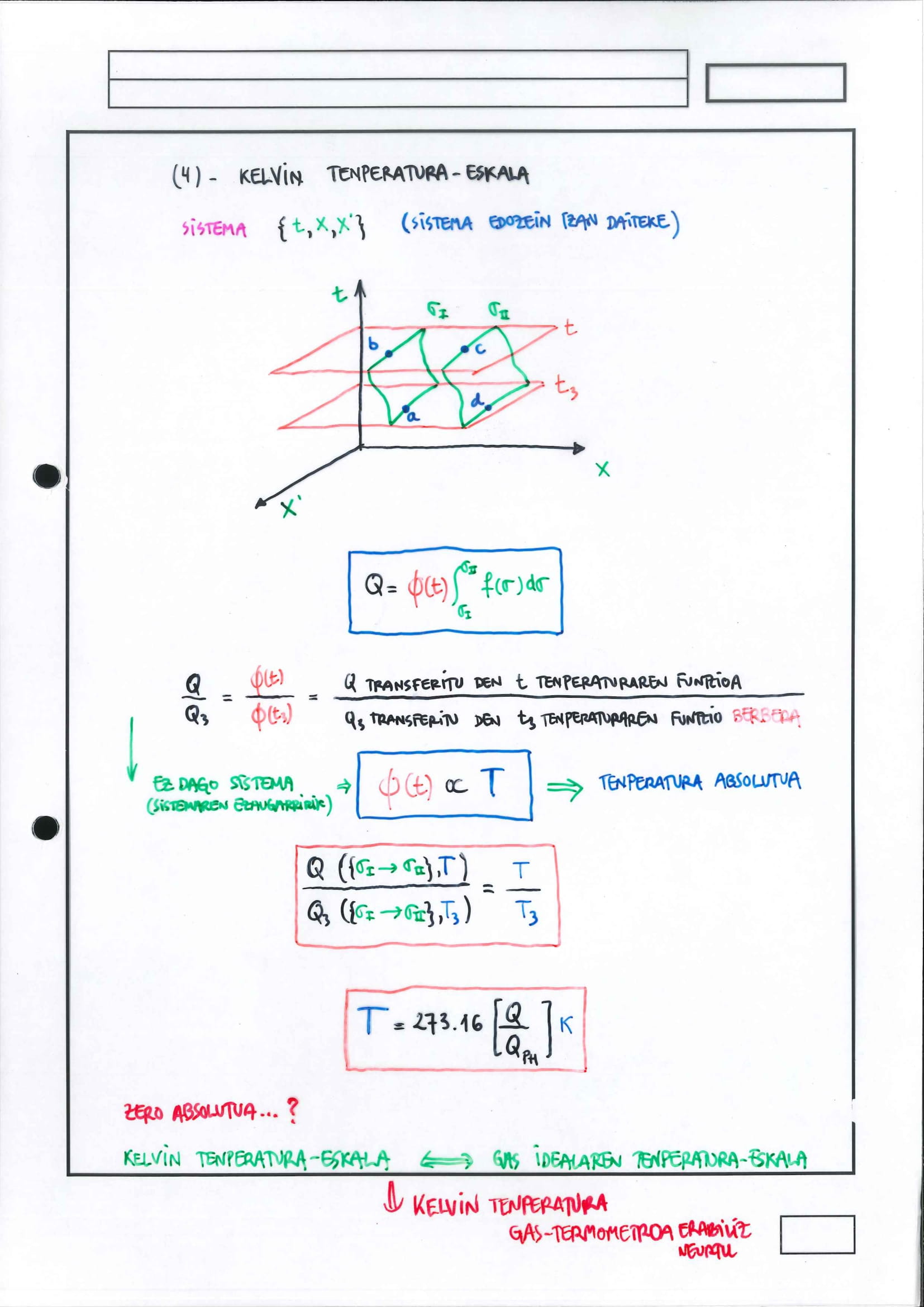
unibertsaltasun horrek ahalbidetzen du tenperatura-eskala absolutua definitzea
Tenperatura-eskala absolutuaren definizioan erabiltzen den aldagai termometrikoa da sistema batek
tenperatura horretan trukatutako beroak badauka mendekotasuna:
sistemarekiko
ibilbidearekiko
baina erreferentziarako hartutako egoera termikoan trukatutako beroaz zatituz gero, beroen arteko zatidurak ez dauka ez sistemarekiko ezta ibilbiderekiko mendekotasunik ere, egoera termikoarekikoa baino ez, erreferentziarako hartutako egoera termikoa bada tenperatura-eskalaren definizioan kontuan hartu beharreko puntu finkoetako bat
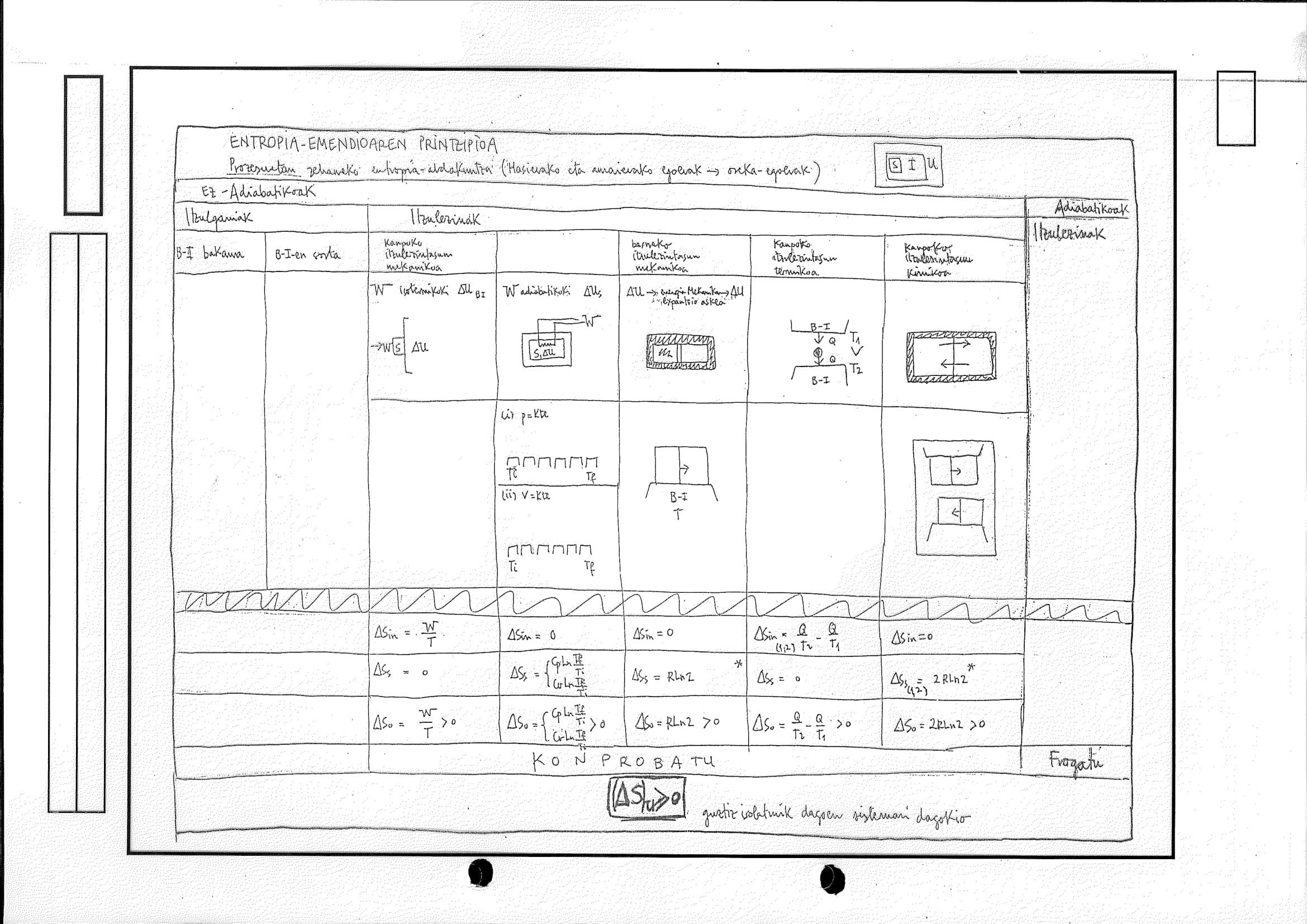
6.6 Bigarren Printzipioaren Ondorioak
Ondorioak 5. Entropia-funtzioaren existentzia

edozein sistemak era itzulgarrian (eta egoera termiko jakinean,
diferentzial zehatza da sistemaren atala sistemari dagokion propietatea adieraziko du
Laburbilduma

Edozein sistemaren kasuan
Edozein prozesuren kasuan
itzulezin (IE)
itzulgarri (IG)
Beti kalkulatu daiteke prozesu horretan sisteman gertatu den entropia-aldaketa
Horretarako, 2 tresna:

Bigarren Printzipioa, entropia-funtzioaren eragiketa-definizioa:
Lehenengo Printzipioa, era itzulgarrian trukatutako beroaren adierazpen diferentziala:
Biak aldi berean:
Prozesua IG bada, zuzenean aplikatu goikoa
Prozesua IE bada, IE-ak lotu dituen
egokia den ordezko prozesu IG, horrek esan nahi du: ondo aukeratzea prozesua deskribatzeko erabiliko diren aldagai independenteak
gehienetan aldagairen bat konstantea izango da: sartu hori aldagai independenteen sortan, bere aldaketak ez baitu ekarpenik egingo eta entropiaren kalkulua erraztuko da
Adibidea

gas idealaren

kasuan (sistema jakina zeinaren informazio guztia, ia-ia, ezaguna den) edozein prozesutan kalkulatu daiteke zer entropia-aldaketa gertatu zaion
Iruzkina:
Bi askatasun-graduko (edo orokorrean, bi askatasun-gradu martxan baino ez duen) sistemaren kasuan, entropia deskribatzeko honako bi aldagai independenteen sortak aukeratu daitezke, besteak beste:
Beraz,
Eta entropiaren eragiketa-definizioa kontuan hartuz:
Hauxe da ondorioa:
Beraz,
Eta entropiaren eragiketa-definizioa kontuan hartuz:
Hauxe da ondorioa:
Eta orokorrean…
Zenbait iruzkin:Bero-iturriari dagokion entropia-aldaketa, definizioz:
Baina bero-iturriak beti trukatzen du bero era itzulgarrian (kuasiestatikoki,
Gainera, bero-iturriaren tenperatura beti da konstante, beraz, integraletik atera daiteke (horixe da, kasu honetan, ibilbidea ezagutzea, ibilbideko integrala, diferentzial ez-zehatz baten integrala kalkulatzeko)
Ondorioz:
kuasiestatikotasuna eta itzulgarritasuna:
definizioz ez dira berdinak: itzulgarriak kuasiestatiko dakar ondorioz, baina kontrara, ez!!
liburuko erabilera praktikoari dagokionez, badira berdinak: liburuaren arabera, kuasiestatiko izatean, azpitik, onartzen ari da itzulgarria dela baita ere
Ariketa bat proposatu:
Aztertu behar den sistemaren ezaugarriak honako hauek dira:
Bero-ahalmen horretan ez dago adierazita zer baldintza esperimentaletan trukatuko duen beroa sistemak, baina, berdin dio, onartuko da, trukea gertatuko den moduari dagokiola aipatutako bero-ahalmena.
Kalkulatu honako hauek:
Sistema eraman da 1-egoeratik,
Lortu:
Unibertsoaren entropia-aldaketa:
Sistemaren entropia-aldaketa:
Ingurunearen entropia-aldaketa:
Jakina, horiek guztiek honako hau betetzen dute:
Onartu hasierako oreka-egoera lortzeko prozesua, hots,
Sistema eraman da 1-egoeratik,
Aurreko ariketa errepikatu, baina, oraingo honetan tarteko bi tenperatura tartekatuz, bestela, dena gertatzen da baldintza berberetan.
… …
…limitera eramanda, hasierako eta bukaerako egoeren artean, infinitu tenperatura tartekatu dira…
6.6 Bigarren Printzipioaren Ondorioak:
metodo teknikoa:
Carnot-en zikloa*:
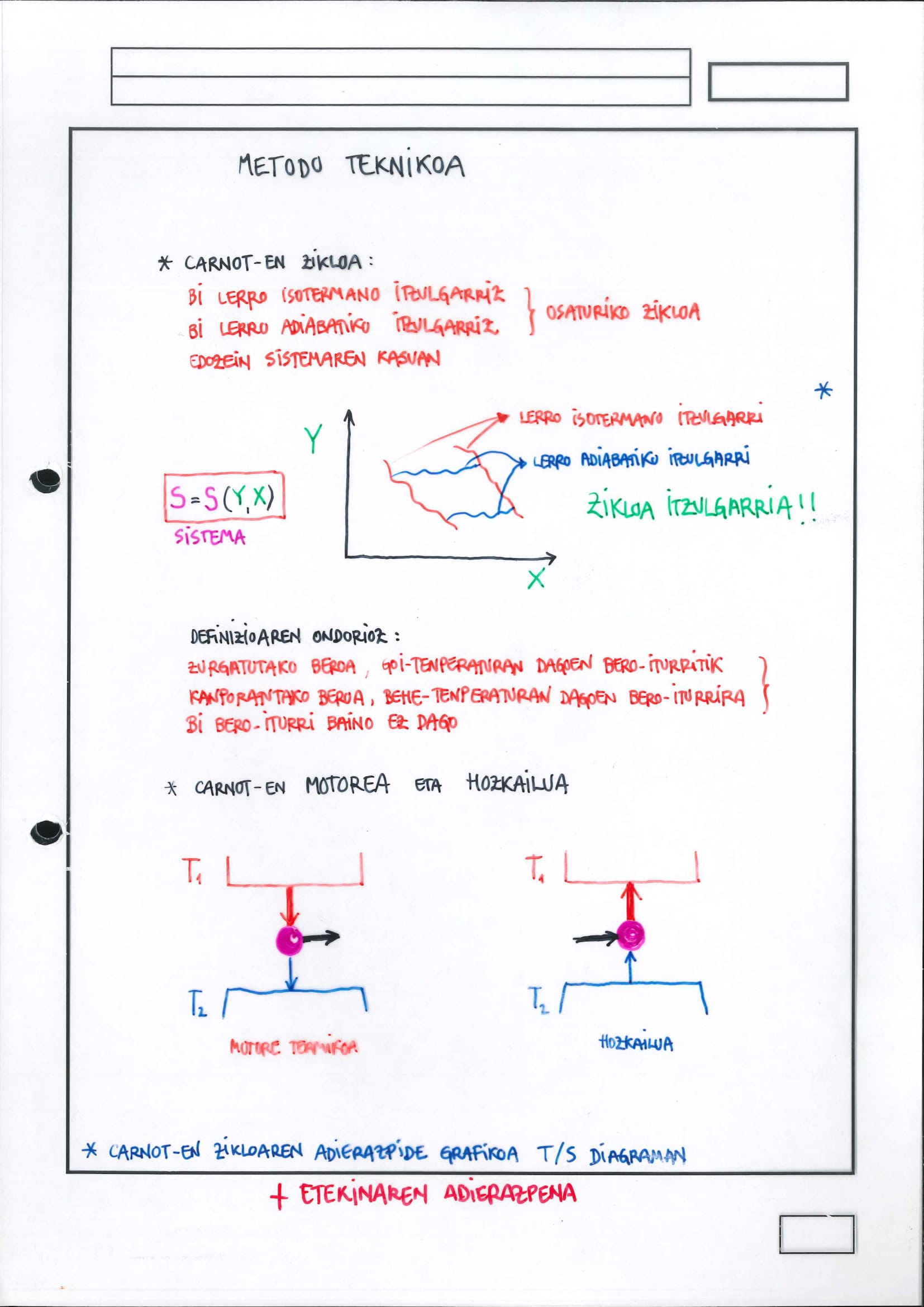
definizioa
iruzkinak/ezaugarriak:
Carnot-en zikloaren adierazpide grafikoa
Carnot-en zikloaren adierazpide grafikoa
Ziklikoki dabilen sistema gas ideala da:
Carnot-en zikloaren adierazpide grafikoa
bestelako diagrametan:
Carnot-en zikloari dagokion etekina, makina termikoan erabilita zikloa eta makina termikoa motor termikoa denean (proposatutako ariketa):
ezaugarriak: 2. Printzipioa erabilita ondorioztatutakoak
Carnot-en zikloaren etekinak ez dauka ziklikoki dabilen sistemarekiko mendekotasunik
Carnot-en zikloaren etekina maximoa da finkatutako bi tenperatura horien artean dabilen edozein motorri dagokionarekin alderatuta
Ariketa-proposamena
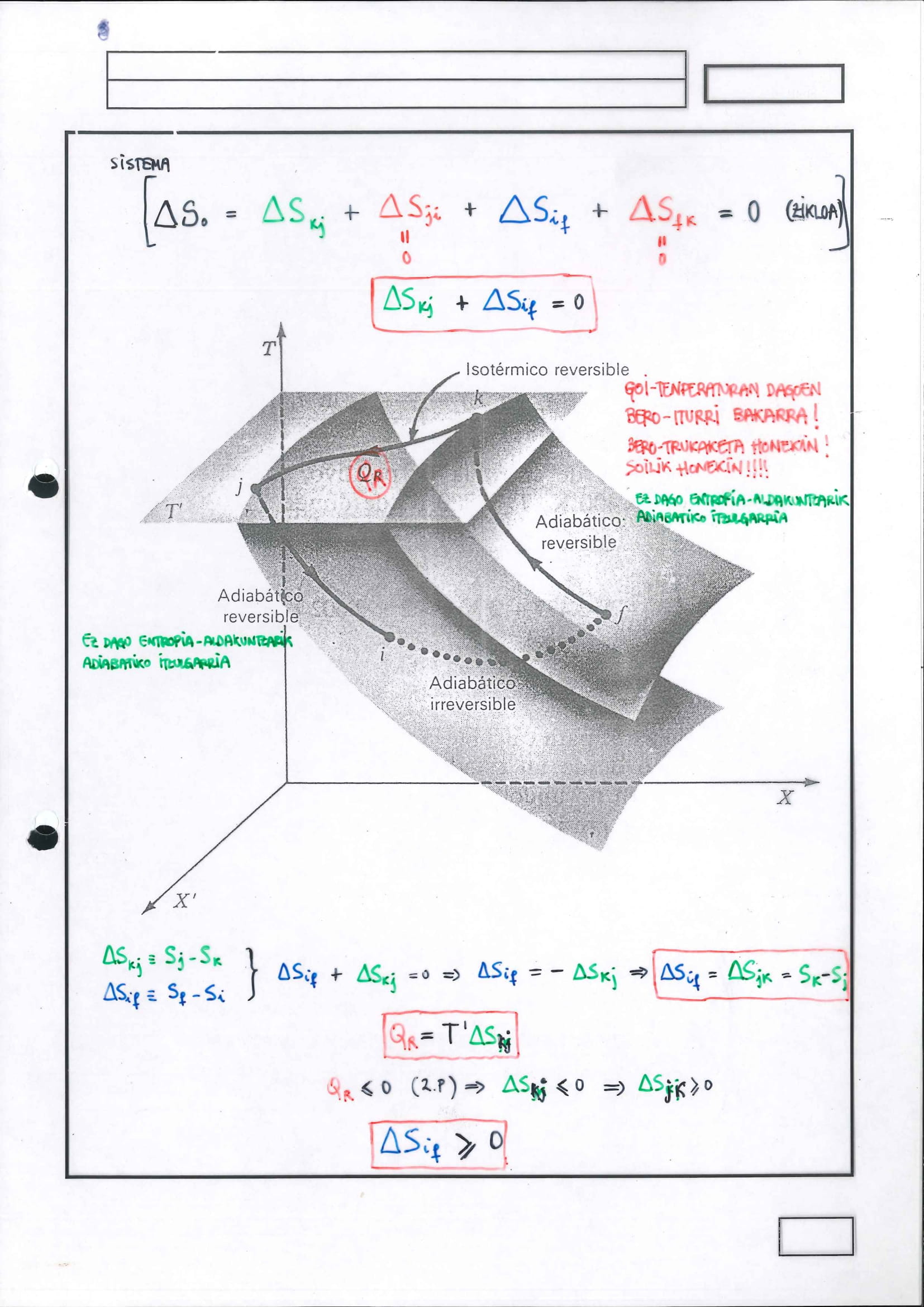
Clausius-en Teorema:

Ez da frogatuko
Hauxe da bere eduki fisikoa:
prozesua, zikloa, IG:
Gainera, berori erabil daitekeZikloko bi puntu aukeratu:
Zikloa bera bi azpiprozesuz osatuta azter daiteke:
Azpiprozesu bakoitzean
prozesua, zikloa, IE:
Kasu honetan,
6.7 Entropia-emendioaren Printzipioa
Iruzkinak:
2 Printzipioak finkatzen du unibertsoaren entropia-aldaketaren zeinua
2 printzipioak finkatzen du unibertsoaren entropia-aldaketak izan dezakeen baliorik txikiena, zero!
2 Printzipioak ez du finkatzen ingurunearen eta sistemaren entropia-aldaketen balio erlatiboak: baturaren zeinua finkatuta dago, hori da baldintza murriztailea, baina, bestela, edozein konbinazio gerta daiteke (harekin bateragarri, jakina)
6.8 Lan Maximoaren Teorema
Kualitatiboki:
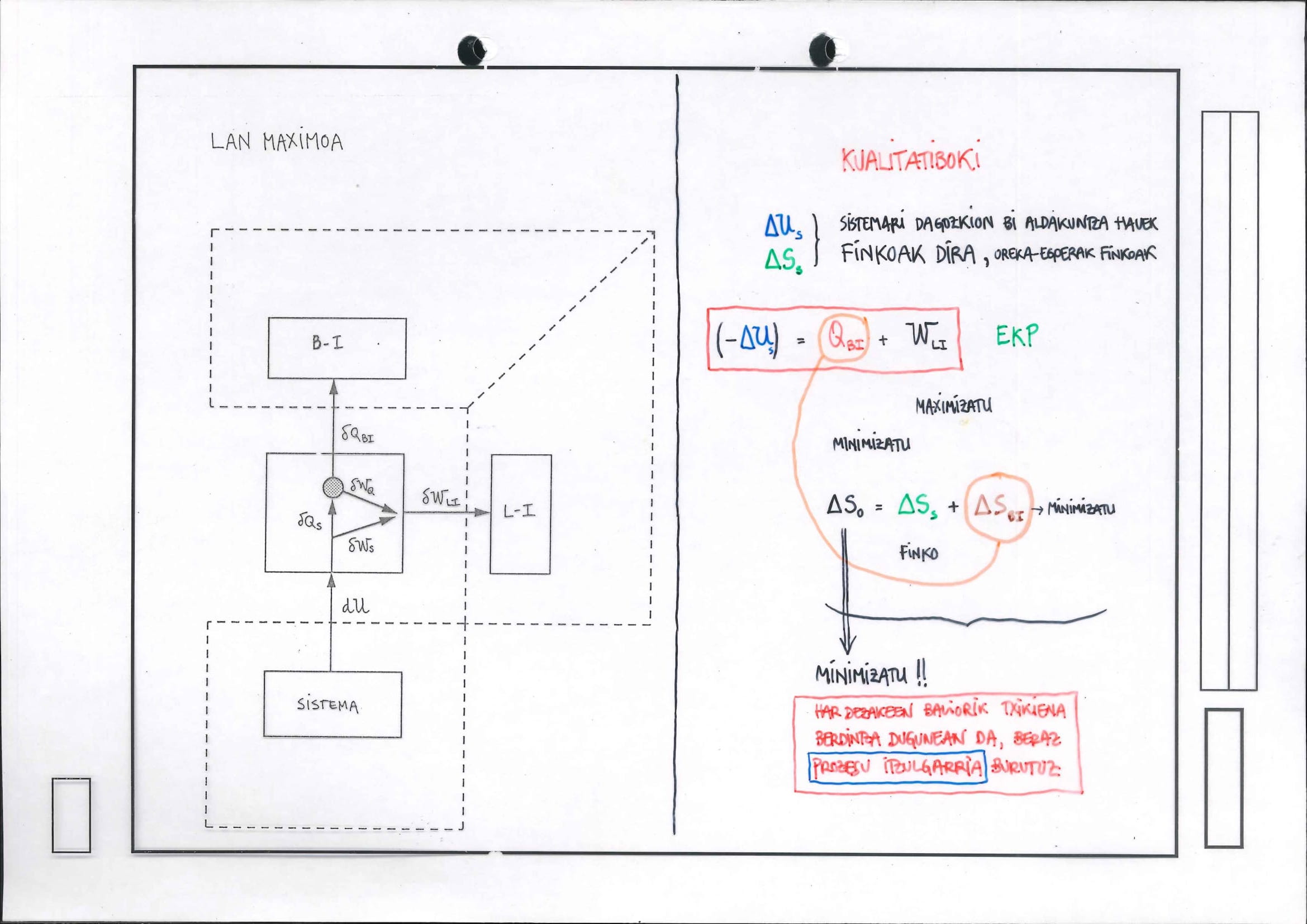
Helburua: Aztergai den sistemaren egoera-aldaketa jakina erabili nahi da lan maximoa (minimoa) lortzeko asmotan
Egoera-aldaketa jakina denez, norberak finkatutakoa esaterako eta sistemaren propietateak egoera-funtzioak direnez (diferentzial zehatzak), horien edozein aldaketa finkoa da
edozein gauza kalkulatzeko, 2 tresna baino ez dago, oraingoz:
lehen printzipioa: energiaren kontserbazioaren printzipioa
bigarren printzipioa: entropia-emendioaren forman, esaterako
gainera, bi tresnak unibertsoari dagozkie: unibertsoan aplikatu behar dira
hipotesiaren arabera, bi tresnetan sistemarekin lotutakoa finkatuta dago
Kuantitatiboki (1):

Irudian adierazi nahi da eragingo den prozesua gertatzen den unibertsoaren inguruneak bi zati dauzka:
bero-iturri (itzulgarria): berak egin dezakeen gauza bakarra (duen askatasun-gradu bakarra) da energia bero moduan trukatzea
edozein prozesutan beti eragiten zaio entropia-aldaketa:
lan-iturri (itzulgarria): berak egin dezakeen gauza bakarra (duen askatasun-gradu bakarra) da energia lan moduan trukatzea
edozein prozesutan inoiz ez zaio eragiten entropia-aldaketa:
lan-iturri itzulgarriaren ikuspuntutik prozesu denak, itzulgarriak direnez (bere izaeraz), kuasiestatikoak dira baina adiabatikoak ere bai, ezin baitu, inolaz ere, beroa trukatu, ez baitauka askatasun-gradu termikorik
Unibertsoaren entropia-aldaketaren atalak dira
sistemaren ekarpena
ingurunetik, bero-iturri itzulgarriaren ekarpena Entropia-aldaketa osoak lotzen ditu bero-iturria eta sistema, azken honen entropia-aldaketaren bidez
Energia-truke osoari dagokionez, hots, unibertsoari dagokion energia-aldaketari dagokionez, eta energia kontserbatu behar denez (1. Printzipioa)
Energiaren balantzeak lotzen ditu lan-iturria eta sistema, azken honen energia-aldaketaren bidez
Kuantitatiboki (2):
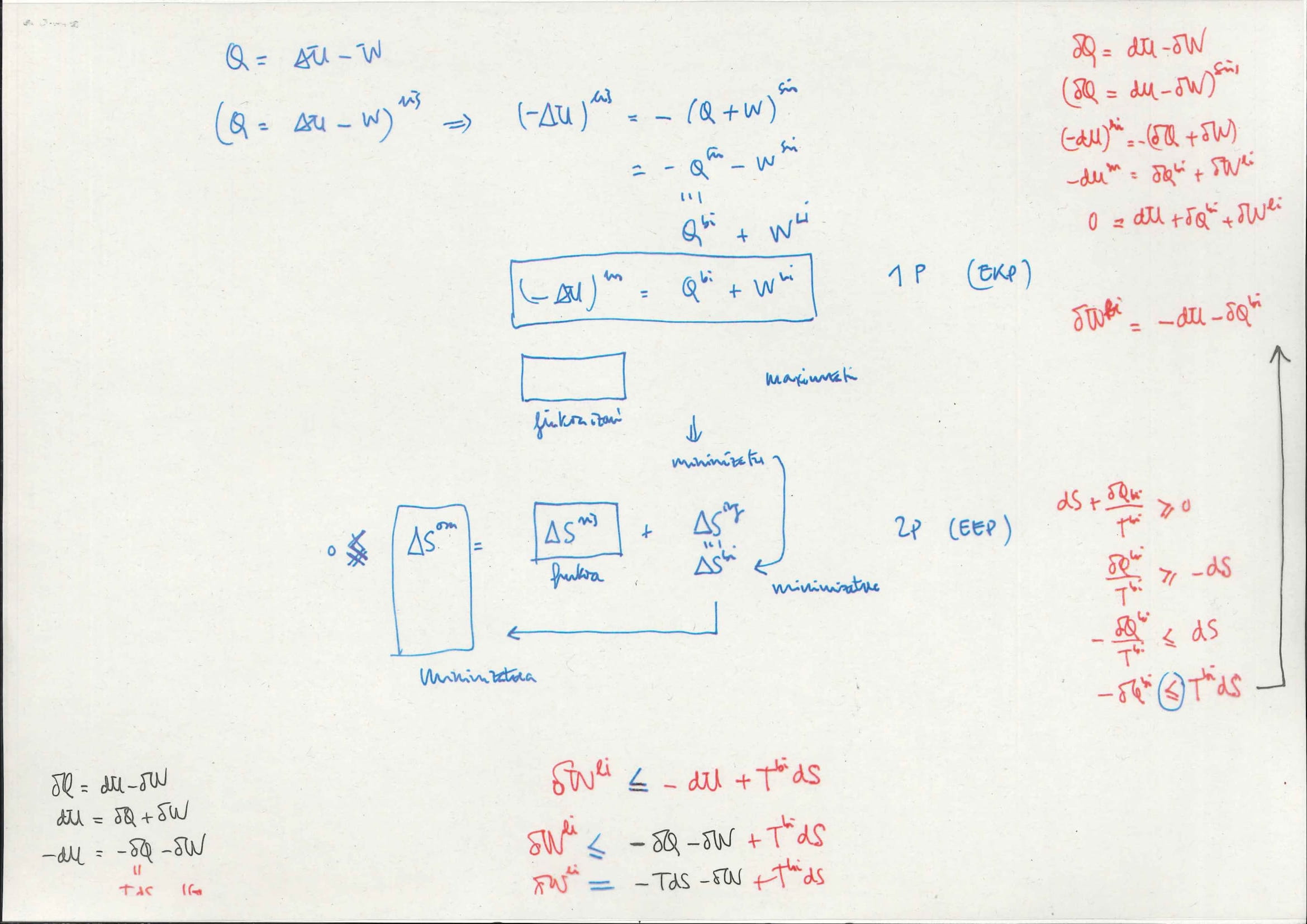
Azken adierazpenaren irakurketa: sistemaren egoera-aldaketa finkotik lor daitekeen lan maximoak 2 atal dauzka:
atalak:
sistemak zuzenean emango duen lana:
lan horren izaera edozein izan daiteke, sistemaren askatasun-graduaren araberakoa: mekanikoa, magnetikoa, elektrikoa, elastikoa…
gehienetan onartuko da horrelako atalik ez dagoela
beraz, nahikoa izango da jakitea sistemak nola trukatzen duen energia bero moduan: sistemaren
sistematik prozesuan zehar tenperatura-diferentziak gertatzen direnez, horiek erabiliz atera daitekeen lan maximoa
horri dagokion adierazpena da Carnot-en makina termikoaren adierazpena:
Kuantitatiboki (3):

Adibideak:
Ariketetako eskemak

Iruzkinak:
Bi sistemen arteko tenperatura-diferentzia
ez da aprobetxatu nahi, lana egiteko: prozesua da IE, berezkoa baita
batak galtzen duen energia besteak irabazten du
horren arabera, sistema bakoitzaren kasuan,
eta trukatutako beroa beti kalkulatu daiteke barne-energia kalkulatuz, diferentzial zehatza da bera
baldintza honek finkatzen du bukaerako egoera termikoa, beroa-ahalmenak (
Hori lortutakoan, kalkulatu daiteke zenbatekoa izan den entropia-aldaketa
(
aprobetxatu nahi da, lana egiteko:
onartuko da sistemek ez dutela lana zuzenean kanporatzen (edo ez dutela kontsumituko lanik, ez dela sartuko)
oraingoan, batak galdutako beroa ez da besteak irabazten duena: bero-trukea modu berezian eragin behar da, zeinean unibertsoaren entropia-aldaketa ez den aldatzen, guztira, baina edozein azpi-prozesu infinitesimaletan ere ez
bi sistemen artean gertatzen den bero-trukea oso berezia da: entropia kontserbatzen baitu, horretarako tartekatu den zerbaiten bidez, jakina
baldintza horrek finkatzen du bukaerako egoera termikoa, bero-ahalmenak (
Lan minimoko edozein problema, lan maximoko problemaren berdina da, kontrako noranzkokoan eraginda
Lan maximoa lortzeko eragin beharreko prozesuak itzulgarri izan behar du; beraz, beti bete daiteke kontrako noranzkoan
Lan minimoaren probleman honako hau eskatzen da (gehienetan, problemaren aldaerak ere badaude): zenbatekoa den egin behar den lana tenperatura berean dauden bi sistemen artean tenperatura-diferentzia jakina eragiteko
Hasierako egoeran, bi sistemen egoera termikoak berdinak dira:
Batean zein bestean lortuko diren lanen balio absolutuak berdinak dira
maximoa eta minimoa estremalak dira (inflexio-puntuarekin batera) eta lehen deribatuak berak ez daki zein den zein, aipatutako hirurek betetzen baitute baldintza berbera lehen deribatuari dagokionez: nulua da
Eta berori da erabili den baldintza bakarra: prozesua itzulgarria denez, unibertsoaren entropia-aldaketa nulua da, baina edozein azpi-prozesu infinitesimaletan, beraz, beti betetzen da
6.8 Lan Maximoaren Teoremaren adibideak
Adibideak:
Problema moten eskemak

Masa finituko bi sistemen arteko tenperatura-diferentzia aprobetxatu lana lortzeko

Masa finituko sistema eta bero-iturriaren arteko tenperatura-diferentzia aprobetxatu lana lortzeko

Bi zalantza argitu:
Besterik gabe lotutakoan masa finituko bi sistema, zergatik kalkulatu daiteke beroa (diferentzial zehatza ez dena) prozesua itzulgarria izango balitz moduan, nahiz eta itzulezina den?
Ikus gorago
Zer gertatzen da, aipatutako edozein prozesutan, bereziki, masa finituko sistema eta bero-iturria besterik gabe lotzean, masa finituko sistemaren masa bera ere aldatzen bada? Mahai gainean utzitako egin berri den kafez betetako potoari gertatzen zaion prozesua
Pentsatzeko
Ariketa proposatu: 27. ariketa
Esku artean
bero-ahalmeneko sistema berdin ditugu; beren tenperaturak dira.
Besterik gabe, elkarren arteko ukipen termikoan jarri dira. Zenbatekoa da trukatu duten bero kantitate osoa?
Demagun, ondoren,
tenperaturan dagoen bero-iturria erabilgarri dela eta horrekin ukipen termikoan jarri direla sistemak. Zenbatekoa da horrelako egoeratik atera daitekeen lan maximoa? Jakina, lortu sistemen bukaerako oreka-egoera termikoa, arestian aipatutako bi kasuetan.
Proposatutako ariketa egin:
Nahiz eta kasu honetan
besterik gabe lotuz gero: prozesua da IEa:
EKParen (1. Printzipioa) ekuazioak finkatuko du zein den bukaerako orekako egoera termikoa, bukaerako tenperatura:
EEParen (2. printzipioa) ekuazioak finkatuko du zein den unibertsoaren entropia-aldaketa, positiboa bera:
lana egiteko asmoz lotuz eta, gainera, lana maximoa izateko: prozesua da IGa:
EKParen (1. Printzipioa) ekuazioak finkatuko du zenbatekoa den aterako den lan maximoa: $
EEParen (2. printzipioa) ekuazioak finkatuko du zein den bukaerako orekako egoera termikoa, bukaerako tenperatura:
6.9 Energia ez-erabilgarria (galdutako energia?)
Kontzeptua eta kalkuluaren adibide erraza:

Frogapena

Energiaren kalitatea: Orokortzea; zuok irakurri eta hausnartu

Iruzkinak:
Iraganerako mehatzatzea: ordenaren bila
Ez dauka zentzurik energia aurrezteak; printzipioz (lehenengo printzipioz), ez da ezer egin behar energia aurrezteko, berez, aurrezten da, kontserbatzen baita. Beste kontu bat da kontserbatzen den energia hori lan egiteko erabili nahi izatea…, horren kasuan, bigarren printzipioak hartzen du parte; haren ondorio bat, entropia bera, erabil daiteke kalitate handiko energia aurreztu behar dela esateko, beti ere, helburua lan egitea bada. Hots, askoz hobea da, errentagarriago lan egitearen ikuspuntutik, entropia txikiko energia erabiltzea lan egiteko entropia handiko energia baino
Ariketa kualitatiboak:
Ariketa proposatu, pentsatzen joateko…: 15. ariketa
Ariketak: 14. ariketa
Gas ideal monoatomiko baten
Likidoak xurgatu duen beroa.
Gasaren entropia-aldaketa eta barne-energiaren aldaketa.
Gasak egindako lana.
Frogatu
Lortu
Zer motatako transformazio izango da prozesua bi kasu limiteetan?
Ariketak: 17. ariketa
Esku artean gas ideal baten 1 mol-eko lagina dugu. 25
Lanik egin ez bada.
Egindako lana 2980 joule izan bada.
Ariketak: 18. ariketa
Bereizte-horma diatermoak eta higikorrak
Ariketak: 20. ariketa
Esku artean dugun hari elastikoa
Hariaren entropia-aldaketa, luzatutakoan.
Hariaren entropia-aldaketa, bigarren prozesuaren ondorioz.
Unibertsoaren entropia-aldaketa, bi prozesuen ondorioz.
Luzapenean egindako lana.
Ariketak: 21. ariketa
Aztertu beharreko gas erreala era askean zabaldu da,
Gasaren entropia-aldaketa, lehenengo prozesuan.
Gasak egindako lana, bigarren prozesuan.
Ariketak: 2. Printzipioarekin lotutakoak, honako hauek
12. Ariketa
16. Ariketa
17. Ariketa
27. Ariketa