Ariketak#
Oinarrizko ekuazioaren eraikuntza#
Zenbait ariketa, adibide
Kontuz ibili behar da oinarrizko ekuazioa eraiki behar denean egoera-ekuazioetatik abiatuta. Oinarrizko ekuazioaren zer forma, energetikoa edo entropikoa, lortu(behar)ko dugun, egoera-ekuazioek esango digute. Beraz, ondo erreparatu egoera-ekuazioetan agertzen diren aldagai naturalei, hortxe baitago gakoa.
Hurrengo sei ariketetan, lortu oinarrizko ekuazioa. Kontuan izan sistema denak hidrostatikoak direla, baina bina egoera-ekuazio baino ez dela ezagutzen enuntziatuetan.
Testuingurua
1. ARIKETA
Testuingurua
2. ARIKETA
Testuingurua
3. ARIKETA
Testuingurua
4. ARIKETA
Testuingurua
5. ARIKETA
Gas ideala
Testuingurua
6. ARIKETA
Van der Waals-en jariakina
Oinarrizko ekuazioaren propietateak eta gehiago…#
Testuingurua
7. ARIKETA
Zenbait sistema termodinamikori dagokion oinarrizko ekuazioa agertuko da ondoren. Dena den, horietariko bost, II, III eta IV postulatuetatik baten edo gehiagoren aurka dago; eta, ondorioz, fisikoki onartezinak dira.
Adieraz itzazu aipatu bostak, eta betegabeko postulatua(k). Adierazpen horietan guztietan,
Onartu erro positibo erreala soilik, berretura frakzionarioa ageri den guztietan.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
(C 1.9.1)
Testuingurua
8. ARIKETA
Lortu
(C 1.9.2)
Testuingurua
9. ARIKETA
Lortu
(C 1.9.3)
Testuingurua
10. ARIKETA
Onartu aurreko ariketan deskribatutako
Sistema konposatuaren energia osoa
Adieraz ezazu entropia
Zenbatekoa da azpisistema bakoitzari dagokion barne-energia sistemak oreka lortu duen kasurako?
(C 1.9.4)
Testuingurua
11. ARIKETA
Lortu ondoko oinarrizko ekuazioko sistemari dagozkion hiru egoera-ekuazioak:
(C 2.2.1)
Testuingurua
12. ARIKETA
Lortu aurreko sistemari dagokion
Adieraz ezazu emaitza
(C 2.2.2)
Testuingurua
13. ARIKETA
Lortu aurreko sistemaren kasuan, eta tenperatura finkoa denean, presioak bolumenarekiko duen mendekotasuna, hautazkoa den eskalako diagraman.
Irudikatu bi tenperatura desberdini dagozkien lerro isotermoak, eta adieraz ezazu zein den bietatik tenperatura handienari dagokiona.
(C 2.2.3)
Testuingurua
14. ARIKETA
Lortu ondoko oinarrizko ekuazioko sistemari dagozkion hiru egoera-ekuazioak.
(C 2.2.4)
Testuingurua
15. ARIKETA
Lortu aurreko sistemari dagokion
(C 2.2.5)
Testuingurua
16. ARIKETA
Lortu ondoko oinarrizko ekuazioko sistemari dagozkion hiru egoera-ekuazioak.
(C 2.2.6)
Testuingurua
17. ARIKETA
kuasiestatikoa den zabaltze adiabatikoan zehar (
(C 2.2.7)
Testuingurua
18. ARIKETA
Lortu, adierazpen entropikoan, ondoko oinarrizko ekuazioko sistemari dagozkion hiru egoera-ekuazioak.
(C 2.3.1)
Testuingurua
19. ARIKETA
Lortu aurreko sistemaren kasuan, eta presioa finkoa den kasuan, tenperaturak bolumenarekiko duen mendekotasuna, hautazkoa den eskalako diagraman.
Irudikatu bi presio desberdini dagozkien lerro isobaroak, eta adierazi zein den bietatik presio handienari dagokiona.
(C 2.3.2)
Testuingurua
20. ARIKETA
Lortu, adierazpen entropikoan, ondoko oinarrizko ekuazioko sistemari dagozkion hiru egoera-ekuazioak:
(C 2.3.3)
Testuingurua
21. ARIKETA
Bi osagaiko sistemari dagokion oinarrizko ekuazioa honako hau da,
Adierazpen horretan
Lehenengo osagaiarekiko iragazkorra baina bigarrenarekiko ez den mintz diatermoak bi gunetan zatitu du
Lehenengo gunean ondoko parametroez ezaugarritutako lagina kokatu da:
Bigarrenean, berriz, ondokoen bidez:
Oreka lortutakoan, zein dira
(C 2.8.1)
Testuingurua
22. ARIKETA
He gasa duen gordailuak 1000 l-ko bolumenekoa da. Gasa 0.5 atm-n eta 20
Lortu sistemari dagozkion amaierako tenperatura eta presioa.
(C 3.4.4)
Testuingurua
23. ARIKETA
Bi sistemari dagozkion egoera-ekuazioak ondokoak dira:
Adierazpen horietan
Oreka lortutakoan, zenbatekoa da sistema bakoitzari dagokion barne-energia?
(C 2.6.3)
Testuingurua
24. ARIKETA
Aurreko ariketako azpisistemak, diatermoa den bereizte-hormaren bidez banatuta daude. Mol kopuruen balioak ondokoak dira:
Oreka lortutakoan,
Zein dira
Zein da oreka-tenperatura?
(C 2.6.4)
Testuingurua
25. ARIKETA
Bi sistemari dagozkion egoera-ekuazioak ondokoak dira:
eta
Adierazpen horietan
Oreka lortutakoan:
zein dira sistema bakoitzari dagozkion energia eta bolumena?
Zein dira presioa eta tenperatura?
(C 2.7.1)
ttttttt
Testuingurua
ARIKETA Gehigarriak
7.3-1. Thermodynamicists sometimes refer to the “first
Derive these equations.
7.3-2. Show that the second equation in the preceding problem leads directly to the relation
and so validates equation 7.36 .
Adiabatic Compression
Consider a single-component system of some definite quantity of matter (characterized by the mole number
(C 7.2.1), (C 7.2.2), (C 7.4.1)
ttttttt
Kalkulu termodinamikoa eta zenbait aplikazio#
Testuingurua
26. ARIKETA
Lortu
(C 7.4.1)
Modu berean ere, lortu, kalkulu termodinamiko hutsa erabiliz, honako koefiziente hauek:
(C 7.4.6):
(C 7.4.17):
Testuingurua
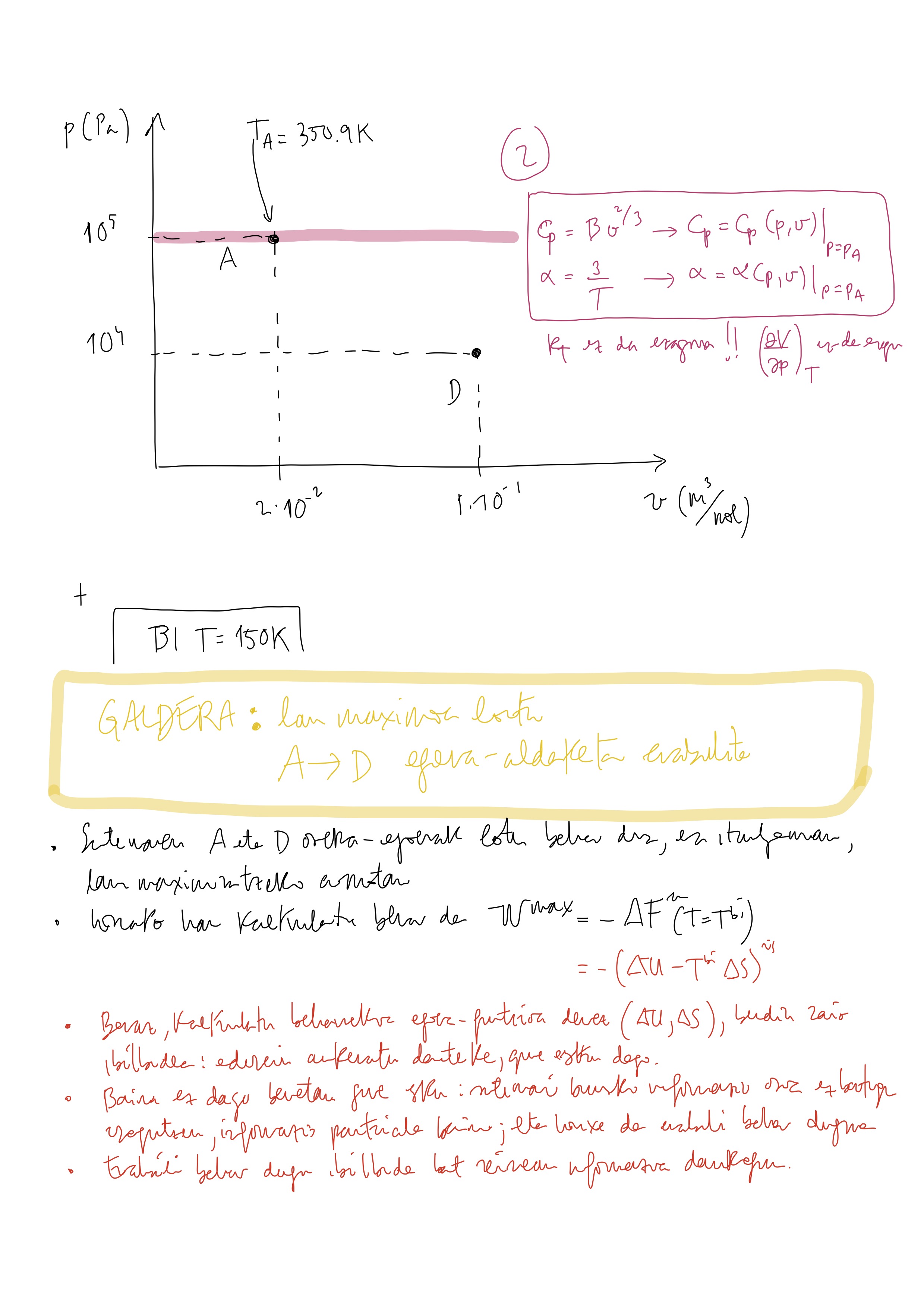
27. ARIKETA
Esku artean dugun gas errealaren bi molek 100 K-eko tenperaturan eta 2 MPa-eko presioan litro bateko gordailua bete dute. 10 cm
Hasierako egoerari dagozkion datuak honako hauek dira:
Testuingurua
28. ARIKETA
Frogatu ondoko berdintza beteko dela eta lortu horri dagokion adierazpena van der Waals-en gasaren kasurako:
(C 7.4.7)
Testuingurua
29. ARIKETA
Frogatu ondoko berdintza beteko dela:
Lortu berdintza horri dagokion adierazpena ondoko egoera-ekuazioa beteko duen sistemaren kasurako:
(C 7.4.8)
Testuingurua
30. ARIKETA
Aurreko ariketako mol bati
Lortu prozesuan sistemak trukatu duen bero kantitatea.
(C 7.4.9)
Testuingurua
31. ARIKETA
Esku artean dugun sistemaren kasuan ezagunak dira ondoko bi propietate hauek:
Adierazpen horretan,
Eztabaidatu zer forma har dezakeen
Lortu (
(C 7.4.22)
Testuingurua
32. ARIKETA
Van der Waalsen egoera-ekuazioa esleitu zaion 1 mol-eko sistemari
Lortu prozesuan trukaturiko bero kantitatea.
(C 7.4.10)
Testuingurua
33. ARIKETA
Esku artean dugun oxigenoaren bi molak 0
Lortu bukaerako presioaren balioa ondoko ekuazioa integratuz:
Onartu ondoko bero-ahalmeneko gas ideala dela oxigenoa:
(C 7.4.11)
Testuingurua
34. ARIKETA
Erraztu honako adierazpen hau:
(C 7.4.13)
Testuingurua
35. ARIKETA
Zabaltze askearen ondorioz esku artean dugun gasaren tenperatura-aldaketa
Lortu presio-aldaketa.
(C 7.4.14)
Testuingurua
36. ARIKETA
Esku artean van der Waals-en fluidoaren 1 mol dugu:
(C 7.4.15)
Testuingurua
37. ARIKETA
Ebatz ezazu aurreko ariketa berbera; baina, kasu honetan, espantsioa adiabatikoa izateaz gain kuasiestatikoa dela onartuz.
(C 7.4.16)
Testuingurua
38. ARIKETA
Bolumenaren
(C 7.4.17)
Testuingurua
39. ARIKETA
Helio gasa erabiliz beteriko zilindroa pistoi batek itxi du. Zilindroaren aldeko horma adiabatikoa, higiezina eta helioarekiko iragaztezina da. Zilindroaren beheko aldea, berriz, isotermoa, higiezina eta helioarekiko iragazkorra da. Horma horren bidez, zilindroa
Lortu sistemaren (
Frogatu konprimigarritasunak dibergentzia izango duela.
Zein da dibergentzia horren jatorri fisikoa?
(C 7.4.18)
Testuingurua
40. ARIKETA
Aurreko ariketako zilindroa Ne gasa erabiliz bete dugu:
Lortu zilindroko presioaren balioa eta sistemaren konprimigarritasuna.
(C 7.4.19)
Ondorengo bi ariketak modu berean abatzi behar dira. Lehenengo eta behin, ebaztean erabiliko diren aldagaiak finkatu behar dira; printzipioz, enuntziatuek berek finkatuko dute: bien kasuan,
Prozedura laburbilduz:
Identifikatu aldagai independenteak
Identifikatu hasierako eta bukaerako oreka-egoerak
Identifikatu prozesuaren adierazpena: aldagai independenteen arteko lotura Lortu aldagien aldakuntza diferentzialen arteko lotura
Identifikatu kalkulatu beharreko koefizientea Kalkulatu koefizientea: lortu adierazpen orokorra
Ordezkatu adierazpen orokorrean enuntziatuko datuak Integratu
Testuingurua
41. ARIKETA
Esku artean substantzia baten mol bakarra dugu.
Lortu
(C 7.4.20)
Testuingurua
42. ARIKETA
Esku artean substantzia baten mol bakarra dugu.
Lortu (
(C 7.4.21)
Testuingurua
43. ARIKETA
Esku artean dugun sistemaren kasuan,
Lortu prozesuan trukaturiko beroa.
(C 7.4.23)
Testuingurua
44. ARIKETA
Aztertuko dugun sistema alboko irudian ageri da; 1 eta 2 zilindroek osatu dute. Irudian ikus daitekeenez, lehenengoa bigarrenaren barnean higi daiteke. Bien artean ez dago marruskadurarik. Marrazturiko hormak adiabatikoak dira eta besteak, aldiz, diatermoak. Hasiera batean sistema osoa oreka-egoeran dago. 1 zilindroa
Lortu:
zilindroen bukaerako tenperaturak eta 2 zilindroaren bukaerako bolumena,
bi sistemetako entropia-aldaketak,
punpak egindako lana eta
inguruneari dagokion entropia-aldaketa.
Eztabaidatu kualitatiboki zenbatekoa izango den sistema osoaren entropia-aldaketa.
Testuingurua
45. ARIKETA
Aztertu beharreko sistema honako hau da:
Sistemari dagokion oinarrizko ekuazioa honako hau da:
Lortu honako hauek:
Testuingurua
46. ARIKETA
Aztertu beharreko sistemari dagokion oinarrizko ekuazioa honako hau da:
Sistemaren bolumena zortzi aldiz handitu dion zabaltze adiabatiko itzulgarriaren ondorioz, zenbatekoa da tenperatura-aldaketa?
Testuingurua
47. ARIKETA
Erraztu honako adierazpen hau:
Koefiziente horri Joule-ren eta Kelvin-en koefiziente deritzo,
Testuingurua
48. ARIKETA
Aztertu beharreko sistemari dagozkion bi egoerak,
Ezagunak dira baita ere honako datua hauek:
lerro adiabatiko itzulgarrien adierazpena:
presio konstantean,
presio konstantean,